近年来含能粘合剂的研究活跃且进展迅速, 主要品种包括叠氮类的聚叠氮缩水甘油醚(GAP)、聚3, 3-双(叠氮甲基)氧丁环(PBAMO), 硝酸酯类的聚缩水甘油醚硝酸酯(PGN)、聚3-硝酸酯甲基-3-甲基氧杂环丁烷(PNIMMO)等, 这些新型含能粘合剂普遍具有高能、钝感等特性, 满足现代武器的发展要求。其中硝酸酯类粘合剂具有与硝酸酯增塑剂相容性好、氧含量高等优点, 可提高火炸药的使用安全性[1]。
硝酸酯粘合剂中, PGN理论密度1.46g·cm-3, 爆热2661kJ·kg-1, 均高于PNIMMO(密度和爆热分别为1.26 g·cm-3和818 kJ·kg-1)[2]。在美国水面武器中心印第安娜总部(NSWC-IH)一为期三年的研究中, 以提高推进剂能量并降低感度为目标, 考察了各种含能粘合剂和新型含能组分, PGN以其高氧平衡和高能量密度被认为是最适于新型武器应用的硝酸酯类粘合剂[3]。
PGN通过阳离子开环聚合制备, 受聚合理论和聚合技术的影响, 早期合成的PGN分子量低、官能度低、产物分离困难、制得的聚氨酯推进剂力学性能差[4]。20世纪90年代以来, 易于工业化的硝化新工艺、新技术降低了PGN单体合成的成本, 同时阳离子聚合理论的发展也推动了PGN聚合的深入研究, 理想官能度和较高分子量的PGN得以合成和应用, 英国防卫所(DERA)、英国ICI炸药公司和美国聚硫公司(ATK)等, 分别或合作在单体的合成、聚合工艺的改进及连续化生产方面推出了不少研究成果[5-10]。
随着应用工作的深入, 研究人员发现常规固化的PGN稳定性较差, 存在脱固化(de-cure)问题, 即PGN与常用异氰酸酯固化形成的聚氨酯, 贮存一段时间后可降解成为流动的液体[11]。不过目前对PGN的固化降解本质尚无定论, 研究人员仍在不断探索研究中。Sanderson等[12]合成了多官能度PGN, 并以芳基异氰酸酯PAPI反应固化, 试样在145 ℉(62.8 ℃)贮存24天, 邵A硬度无明显下降; 但以脂肪族异氰酸酯N-100/HMDI固化时, 同样贮存条件下邵A硬度大幅下降。Desai[13]采用包括缩水甘油(GA)、3-硝酸酯甲基-3-甲基氧杂环丁烷(NIMMO)等在内的多种环醚对PGN进行封端改性, 凝胶渗透色谱(SEC)和核磁分析显示, 各种环醚的封端效率很低, 改性效果有限。Kim等[14-15]则采用新型结构单体, 通过增加侧链的C原子数合成了新型结构的粘合剂。
在国内, 中物院的马卿等[16]分别以甘油和环氧氯丙烷为起始原料合成了单体, 并以此开展了聚合探索, 合成了数均分子量950~1200的PGN, 不过未见固化试验报道; 黎明化工研究设计院有限责任公司较为系统地开展了PGN单体及聚合物的合成工艺研究, 合成的PGN分别经兵器204所[17], 航天806所[18]、北理工[19]等单位初步应用, 取得了一些实用结果。但总体来说, 国内有关PGN的合成及应用报道还非常有限。本文以高纯度缩水甘油硝酸酯(GN)为原料, 通过聚合工艺控制, 制备了两种较高分子量的PGN; 研究了PGN与常用异氰酸酯反应固化的条件, 制成的PGN聚氨酯弹性体, 固化稳定性优良, 可为PGN的深入应用提供参考。
2 实验部分 2.1 试剂与仪器缩水甘油硝酸酯(GN), 含量≥99.5%, 自制; BF3 · THF, 自制; 1, 4-丁二醇(BDO)、CH2Cl2、Na2CO3、甲醇, 四氢呋喃(THF), 分析纯, 天津科密欧化学试剂有限公司; 二月桂酸二丁基锡, 化学纯, 北京中联化工试剂厂; N-100, NCO 5.25 mmol/g, 黎明化工研究设计院有限责任公司; 甲苯二异氰酸酯(TDI)、二环己基甲烷二异氰酸酯(HMDI)、多苯基多亚甲基多异氰酸酯(PAPI)、三羟甲基丙烷(TMP), 进口分装; 三苯基铋(TPB), 上海有机所。
TA公司Q2000差式扫描量热仪(DSC), N2流速50 mL·min-1, 升温速率10 ℃·min-1, 样品量10~15 mg; 东曹公司HLC8320凝胶渗透色谱仪(GPC), 色谱柱TSK gel G4000+G3000+G2300, 流动相THF, 流速1.0 mL·min-1, 柱温40 ℃, PS标样; 德国Bruker公司VERTEX70红外光谱仪, 试样溶解于DMF中, KBr盐片涂膜, TGS检测器, 4 cm-1分辨率, 扫描16次, 扫描范围400~4000 cm-1; Bruker公司AVANCE DRX500超导核磁共振波谱仪, 5 mm样品管, 内标物四甲基硅烷(TMS); 上海良平仪器仪表公司PZ-D5液体比重天平, 25 ℃; 上海六菱仪器厂LX-A型橡胶硬度计, 按GB/T2941-91方法测试样品邵A硬度; 羟值, 按GJB 1327A-2003 4.6.1方法配制酰化剂, 酰化温度(60+1) ℃, 酰化反应1 h, 进行电位滴定; 美国Dupont 2960热重-差热联用仪(TG-DTA), N2流速150 mL·min-1, 升温速率10 ℃·min-1, 样品量3~5 mg; 热安定性, 按GJB77B-2005方法503.2“安定性阿贝尔法”进行测试。
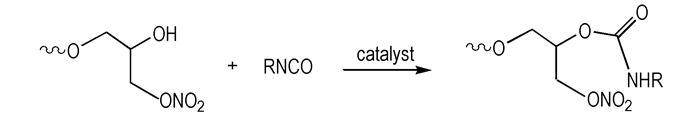
2.2 实验过程 2.2.1 PGN的合成合成原理见Scheme 1。
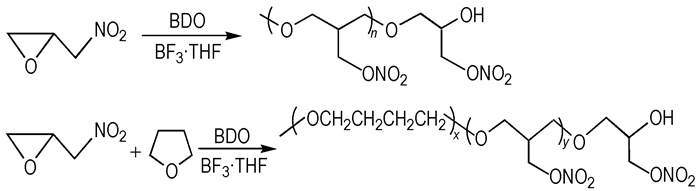
|
| Scheme 1 Synthesis of PGN |
干燥的四口瓶中加入计量的BDO、BF3 ·THF, 搅拌反应一段时间, 降温至10~15 ℃, 滴加单体(GN/GN-THF)的CH2Cl2溶液, 控制加料速度和冷浴温度, 使体系温度不超过25 ℃。单体加料结束后, 继续搅拌反应2 h。然后以碱液中和, 水洗有机相至中性, 有机相经萃取剂萃取3~5次, 真空脱溶剂及水分, 得淡黄色粘稠液体。
结构分析: IR(cm-1): 3444(—OH); 2875(—CH2); 1632, 1279, 992, 859(—ONO2); 1120(—COC—); 1H NMR(δ): 1.60(—CC
PGN的固化反应见Scheme 2。
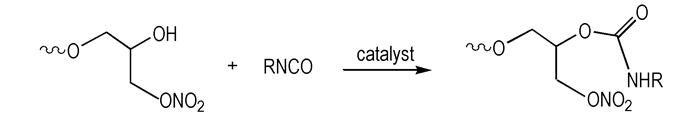
|
| Scheme 2 The curing reaction of PGN |
三口瓶中加入PGN和TMP, 搅拌升温至65 ℃并真空脱水30 min, 按比例加入异氰酸酯固化剂及催化剂, 搅拌反应后真空脱气。将反应物料浇注于模具中, 于60 ℃干燥箱中反应固化。待完全固化后脱模, 试样在室温平衡24 h后进行硬度测试; 随后将试样置于(60+1) ℃恒温老化箱贮存, 定期取样测试邵A硬度。
3 结果与讨论 3.1 聚合条件对PGN主要性能的影响以BDO为起始剂合成了两种理论官能度为2的PGN, 主要性能测试结果见表 1。
| 表 1 PGN的主要性能 Tab.1 The main properties of PGN |
表 1中PGN-Ⅰ、PGN-Ⅱ分别为共聚物和均聚物。由表 1可看出, PGN均聚物密度较高, 接近文献报道的理论值(1.46 g·cm-3)。同时均聚物的玻璃化转变温度Tg和粘度η相对较高, 主要是因为均聚物分子结构规整, 加之侧链为强极性的硝酸酯基团, 分子间作用力强, 分子链的旋转受限; 随分子量提高, 分子链的缠结作用加强, 导致Tg和η大幅提高。图 1是均聚物分子量与粘度和玻璃化温度的对应曲线, 可看出数均分子量从500提高到2500左右时, 相应的粘度增加近20倍、玻璃化温度提高10 ℃以上。
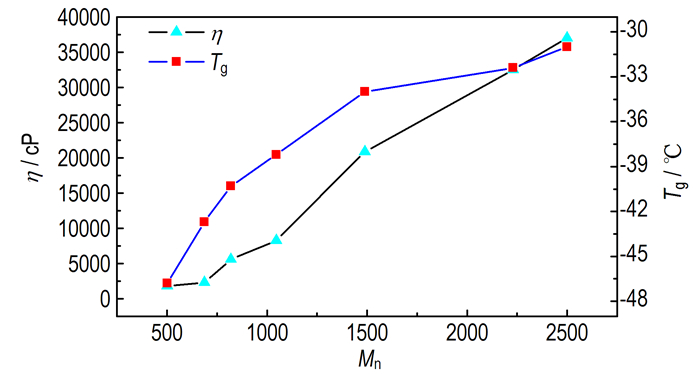
|
| 图 1 均聚PGN分子量对粘度、玻璃化温度的影响 Fig.1 Effects of average molecular mass of PGN on the viscosity and glass transition temperature |
共聚物由于在分子链中引入柔性的THF链段, 打破了聚合物分子结构的规整性, Tg和η大幅下降。PGN-Ⅰ的分子量高于PGN-Ⅱ, 但其Tg和η分别较均聚物降低了约26 ℃和82%。不过受THF引入的影响, 共聚物的密度有所降低。
PGN的TG-DTA曲线如图 2所示。由图 2可看出, PGN的热分解是在一个阶段内完成的, 在10 ℃·min-1的升温速率下, PGN失重5%的温度达到195 ℃。PGN的热稳定性主要取决于分子侧链上硝酸酯基(—ONO2)的热稳定性, 150 ℃之前硝酸酯基分解缓慢, 样品的失重和放热均不明显, 升温至176 ℃左右时, 硝酸酯基加速分解, 样品快速失重, 对应产生放热峰。在最大放热峰温时, 两样品的剩余质量百分数分别为67.3%、52.3%, 此时样品的失重百分数(32.7%、47.7%)接近PGN中硝酸酯基的理论质量分数(31.7%、50.4%)。
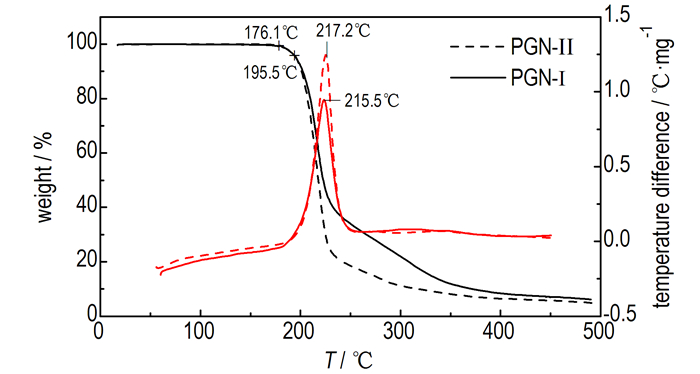
|
| 图 2 PGN的TG-DTA曲线 Fig.2 TG-DTA curves of PGN |
PGN的端羟基类型可通过13C NMR图谱推定。图 3、图 4分别为两种PGN样品的13C NMR图谱。
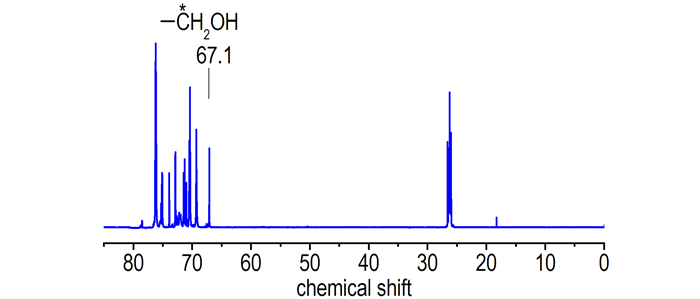
|
| 图 3 PGN-Ⅰ的13C NMR图谱 Fig.3 13C NMR spectrum of PGN-Ⅰ |
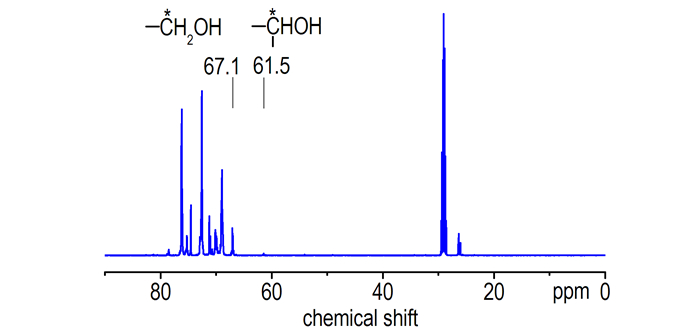
|
| 图 4 PGN-Ⅱ的13C NMR图谱 Fig.4 13C NMR spectrum of PGN-Ⅱ |
由图 3和图 4可看出, 两样品的羟基碳位移基本都是δ67.10处的仲羟基特征碳化学位移, PGN-Ⅱ虽在δ61.5处有伯羟基碳的化学位移, 但位移峰很弱, 表明PGN的端羟基基本上为反应活性相对较低的仲羟基。
为了考察实际的反应和固化情况, 比较了不同催化条件下PGN与几种常用异氰酸酯的反应, 结果见表 2。表 2中催化剂用量为0.1%~0.3%(质量分数), 以试样完全固化时确定固化时间。
| 表 2 催化剂对PGN固化反应的影响 Tab.2 Effects of catalyst on the curing reaction of PGN |
由表 2可看出, 催化剂对PGN的固化反应影响较大。无催化剂时, 仅PAPI、TDI可与PGN在较短时间内完成固化, 观察所得的聚氨酯弹性体表面平整, 触试弹性良好; N-100反应固化情况稍差, 在有限时间内不能充分固化, 触试弹性较差; 以HMDI为固化剂的试样, 在2周的观察期内试样未完全固化, 仅为凝胶状。使用催化剂DBTDL或TPB, 显著提高了PGN与几种异氰酸酯反应固化的速度, 所有试样均在可24 h内完成固化, 得到触试弹性良好的弹性体。
研究中也发现, 以DBTDL为催化剂时, 由于DBTDL较高的催化活性, PGN与PAPI、N-100、TDI反应时凝胶偏快, 工作时间偏短, 不利于浇注。因此在具体应用时, 可根据所选用异氰酸酯品种、工艺操作需要等调整催化剂的使用。
3.2.2 固化反应条件对PGN弹性体硬度的影响以合成的PGN制备聚氨酯弹性体, 考察了主要反应条件对弹性体性能的影响。固化参数R(NCO/OH)和配方设计参数ρT(三官能度羟基/总羟基)对弹性体邵A硬度的影响结果如图 5所示。
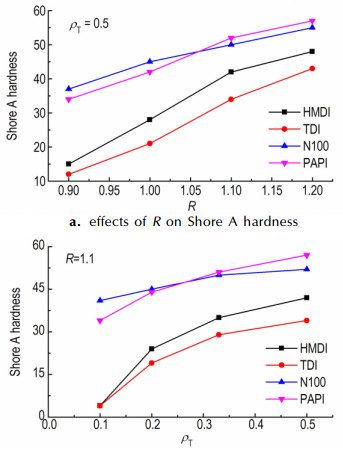
|
| 图 5 R和ρT对PGN弹性体硬度的影响 Fig.5 Effects of R and ρT on the hardness of PGN-based elastomers |
由图 5可看出, 在试验选定的参数范围内, 随R、ρT的提高, PGN弹性体硬度升高。因为随R值增大, 大分子链间的交联点增多, 网络结构更加完善; 同时, 异氰酸酯所提供的极性基团增多也使分子间作用力增强, 赋予弹性体更多的刚性; TMP中含有三个羟甲基, 在PGN与异氰酸酯的反应中, 可同时起到扩链剂和交联剂作用。随着TMP用量提高(ρT增大), 大分子扩链使聚合物分子量提高的同时, 也在体系中引入了更多的化学交联点, 使得交联网络结构更加完整, PGN弹性体硬度明显提高。
由图 5也可看出, 其它条件相同时, 以PAPI、N-100固化的弹性体, 硬度相对较高, 以TDI和HMDI固化的弹性体硬度相对较低。这应该与所用异氰酸酯的官能度有关, TDI、HMDI为二官能度异氰酸酯, 同样条件下交联密度相对较低, 特别是当ρT≤0.2时, 固化后的弹性体偏软; PAPI、N-100官能度较高, 同样固化条件下交联密度高, 赋予材料更多的刚性, 使弹性体硬度可在较高水平调整。不过在以PAPI、N-100为固化剂时, 随ρT值增大, 弹性体交联密度进一步增加, 弹性体变硬, 形状恢复性能减弱, 导致脆性增加。综合考虑, 选择合适的固化条件为: R =1.1~1.2、ρT= 0.3~0.5。
研究中也发现, 尽管PAPI的官能度低于N-100, 但其他条件一致的情况下, 以PAPI反应固化制得的弹性体硬度却与使用N-100固化的弹性体硬度相当甚至更高, 这应该是PAPI中刚性苯环结构与较高的交联密度共同作用的结果。
3.2.3 PGN的固化稳定性为了考察PGN的固化稳定性, 将固化制得的PGN弹性体在(60+1) ℃条件下贮存, 各试样硬度随时间的变化结果见表 3。表 3中PGN的固化条件为: 0.1%DBTDL为催化剂, R=1.1, ρT=0.5。
| 表 3 PGN弹性体硬度随时间的变化(60 ℃) Tab.3 Change in Shore A hardness of PGN-based elastomers with time(60 ℃) |
试验中发现各试样存在不同程度的后固化情况, 在固化的初始阶段试样硬度变化较大, 所以以试样固化一周后的硬度作为初始硬度, 并开始计时。由表 3结果可看出, 在所选定的固化条件下, 贮存60天内, 所有试样的硬度基本无下降, 表明所研制PGN无论与芳基异氰酸酯还是脂肪族异氰酸酯反应固化, 均表现出了良好的稳定性。继续延长贮存时间至90天时, 所有试样外观结构完整, 未发现粘结、鼓泡等明显降解问题; 当固化剂选用N-100时, 以PGN均聚物固化的试样, 弹性体硬度稍有下降; 以PGN共聚物固化的试样, 硬度无明显下降。表明共聚更利于PGN固化稳定性的提高。
4 结论(1) 以含量≥99.5%的GN为原料, 合成了两种理论官能度为2、数均分子量3000左右的PGN。PGN均聚物密度达到1.459 g·cm-3, 接近文献报道的理论值(1.46 g·cm-3); PGN共聚物的密度低于均聚物, 但玻璃化温度和粘度分别较均聚物降低约26 ℃和82%。
(2) PGN的热稳定性取决于侧链硝酸酯基的稳定性, 在10 ℃·min-1的升温速率下, 失重5%的温度达到195 ℃。
(3) 无催化剂时, PGN仅可与TDI、PAPI反应并在较短时间内固化; 以0.1%~0.3%的DBTDL或TPB为催化剂时, PGN可与TDI、PAPI、N-100、HMDI等快速反应固化。
(4) 提高固化参数R和配方设计参数ρT, PGN弹性体的刚性大、硬度提高, R为1.1~1.2、ρT为0.3~0.5时PGN弹性体性能较好。
(5) 以TDI、PAPI、N-100、HMDI等固化的PGN弹性体经60 ℃贮存试验60天, 邵A硬度无明显下降; 贮存90天, 所有固化试样无明显降解情况。相对于均聚物, PGN共聚物更利于PGN固化稳定性的提高。
| [1] |
罗运军, 葛震. 含能粘合剂合成研究新进展[J].
火炸药学报, 2011, 34(2): 1-5. LUO Yun-jun, GE Zhen. New research progress in the synthesis of energetic binder[J]. Chinese Journal of Explosives & Propellants, 2011, 34(2): 1-5. |
| [2] |
Arthur Provatas. Energetic Polymers and Plasticisers for Explosive Formulations-A Review of Recent Advances, DSTO-TR-0966[R], 2000.
|
| [3] |
Leeming W B H, Marshall E J, Bull H, et al. An investigation into polyglyn cure stability[C]//27th International Annual Conference of ICT. Karlsruhe, Germany, 1996.
|
| [4] |
周劲松, 于海成, 冯渐超, 等. 聚缩水甘油醚硝酸酯合成研究进展[J].
化学推进剂与高分子材料, 2003, 1(6): 9-12. ZHOU Jin-song, YU Hai-cheng, FENG Jian-chao, et al. Research progress on synthesis of the polyglycidyl ether nitrate[J]. Chemical Propellants & Polymeric Materials, 2003, 1(6): 9-12. |
| [5] |
Miller R D. Process of producing improved poly(glycidyl nitrate): EP 0471489A2[P]. 1991.
|
| [6] |
Thomas K H, Harold E J. Continuous process and system for production of glycidyl nitrate from glycerin, nitrate acid and caustic and conversion of glycidyl nitrate to Poly(glycidyl nitrate):US 0138481A1[P]. 2004.
|
| [7] |
Desai H J, Cunliffe A V, Lewis T. Synthesis of narrow molecular weight α, w-hydroxy telechelic poly (glycidyl nitrate) and estimation of theoretical heat of explosion[J].
Polymer, 1996, 37(15): 3 |
| [8] |
Willer R L, Stern A G, Day R S. Isotactic poly (glycidyl nitrate) and synthesis thereof: US 5264596[P]. 1993.
|
| [9] |
Cannizzo Louis F, Highsmith T K. A low cost synthesis of polyglycidylnitrate[C]//The Proceedings 31st ICT, Karlsruhe, Germany: DWS Werbeagentur und Verlog Gmbh, 2000.
|
| [10] |
Bagg G, Stewart M J, Leeming W B H, et al. Manufacture of energetic binders using N2O5[C]//The 21st Int Ann Conf of ICT. Karlsruhe: ICT. 1991.
|
| [11] |
Bull H, Bunyan P F, Cunliffe A V, et al. An investigation into thermal stability of end-modified polyglyn[J].
Energetic Materials-Production, Processing and Characterization, 1998: 89 |
| [12] |
Sanderson A J, Martins L J. Method for making stable curedpolyglycidyl nitrate: US 20050133128A1[P], 2005.
|
| [13] |
Desai H. Studies of the cationic polymerization ofvinylic and energetic cyclic ether monomers[D]. The University of Aston in Birmingham, 1995.
|
| [14] |
JinSeuk Kim, Jin Rai Cho, Keun Deuk Lee, et al. Glycidyl di-nitropropyl carbonate and poly(glycidyl di-nitropropyl carbonate): US6706849[P]. 2004
|
| [15] |
Jin Seuk Kim, Jin Rai Cho, Keun Deuk Lee, et al. 2-Nitratoethyl oxirane poly(2-nitratoethyl oxirane) and preparation method thereof:US7288681B2[P]. 2007.
|
| [16] |
马卿, 李金山, 李洪珍. 含能粘结剂聚缩水甘油硝酸酯的合成与表征[J].
合成化学, 2008, 16(6): 628-631. MA Qing, LIN Jin-shan, LI Hong-zhen. Synthesis and characterization of energetic binder poly(glycidyl nitrate)[J]. Chinese Journal of Synthetic Chemistry, 2008, 16(6): 628-631. |
| [17] |
刘萌, 李笑江, 王晗, 等. PGN与固体推进剂主要组分的相容性初探[J].
化工新型材料, 2015, 43(3): 212-214. LIU Meng, LI Xiao-jiang, WANG Han, et al. Compatibility and interaction of PGN with some propellant component[J]. New Chemical Materials, 2015, 43(3): 212-214. |
| [18] |
尚冬琴, 黄宏勇. PGN/AND推进剂的燃烧性能[J].
含能材料, 2010, 18(4): 372-376. SHANG Dong-qin, HUANG Hong-yong. Combustion properties of PGN/AND propellants[J]. Chinese Journal of Energetic Materials, 2010, 18(4): 372-376. |
| [19] |
ZHANG Zai-juan, WANG Gang, LUO Nan, et al. Thermal decomposition of energetic thermoplastic elastomers[J].
Journal of Applied Polymer Science, 2014, 13: 40965 |
PGN were synthesized and cured. The curing characteristics of PGN were investigated.
