近年来,含能材料(EMs)的研究方向已发生转移,人们除要求这些化合物具有优异的应用性能外,也希望其满足安全性和环境友好的需求。传统含能材料,如黑索今(RDX)、奥克托今(HMX)等爆轰性能虽良好,但撞击和摩擦感度较高,结构中含有硝基,在使用中会产生大量对环境有害的物质[1],因此考虑到环保及安全性因素,以富氮化合物为代表的绿色含能材料(GEMs)应运而生。这类化合物具有挥发性低、感度低、含氮量高、热稳定性高、爆速爆压高、合成工艺简单、性能易于调节及爆炸产物主要为清洁的N2等优点[2-3]。此外,它们的能量释放方式与传统含能材料有着本质区别,其能量主要来源于分子中大量的C—N、N—N及N=N键,而非碳骨架的氧化[4],使得该类化合物不仅具有较高的生成焓且结构也易于调控。富氮化合物也因此成为当前含能材料领域发展的主流。
随着对离子液体研究的不断深入,含能离子盐逐渐被引入到单质炸药的设计中,成为富氮含能化合物研究的热点[5-6]。含能离子盐中的阴阳离子具有很好的可调节性,这为新型含能材料分子结构的设计及性能的调控提供了诸多可能。如:将负电荷有效分散至与爆炸性基团相连的电子云密度薄弱的化学键上,将有效提高炸药分子的抗剪切力,降低感度[7]。在当前已报道的诸多含能离子盐中,四唑特别是双环四唑类含能离子盐,因四唑环共轭、含氮量高及四唑环间存在π-π键作用的特点,使其具有密度高、化学稳定性好及产气量大的独特优势[8-11],其中二(5-胺基-1, 2, 3, 4-四唑)二肼盐(Hy2BTA)就属于这类物质。
Hy2BTA最早是由Hiskey[12]在2001年利用复分解反应制备得到的一种白色粉末状固体,其含氮量高达83.9%,密度为1.72 g·cm-3,爆速为9926 m·s-1,爆压为34.9 GPa,生成焓高达671 kJ·mol-1。此外,与其母体化合物双四唑胺(H2BTA)相比,Hy2BTA还具有不易吸湿和不易包藏溶剂的特点[13],其优异的物化性能和简单的制备工艺相对于传统的HMX和RDX有着明显优势[14-15],是一种极具潜力的新型绿色含能材料。然而,目前针对该化合物的研究主要集中在合成方法及结构表征方面,其详细的热分解特性及分解机理尚未见报道[13]。本研究从分解过程、分解温度、放热量、分解产物和分解机理等方面探讨了Hy2BTA的热分解行为,对其实际应用有重要参考价值。
2 实验部分 2.1 试剂与仪器Hy2BTA纯度>99%,北京理工大学; TGA/DSC1型热重/差示扫描量热联用仪和HS82型热台,梅特勒-托利多国际贸易(上海)有限公司; FTIR Nicolet 6700型傅里叶红外光谱仪,Thermo Fisher Scientific(中国)公司,其中气体红外采用TGA-FTIR气体池附件; GAM 200型质谱仪,北京瑞士安维公司。
2.2 实验条件TG-DSC:试样量2~3 mg,样品研成粉末后在真空烘箱中40 ℃下干燥24 h,升温速率5, 10, 15, 20 ℃·min-1,温度范围50~400 ℃,金属铝40 μL坩埚,载气为He气,可以避免对分解产物的干扰及对TG造成的漂移,气体流速40 mL·min-1。
FTIR:气体红外的气体池温度180 ℃,传输管道温度170 ℃,He流速50 mL·min-1,扫描波数范围400~4000 cm-1,扫描模式为吸光度,分辨率2 cm-1,扫描29次进行光谱累加。
MS:电子轰击(EI)离子源,四级杆质量分析器,采用多离子检测(MID)模式,二次电子倍增器(SEM)电压1000 eV,进样口温度150 ℃,传输管道温度170 ℃。
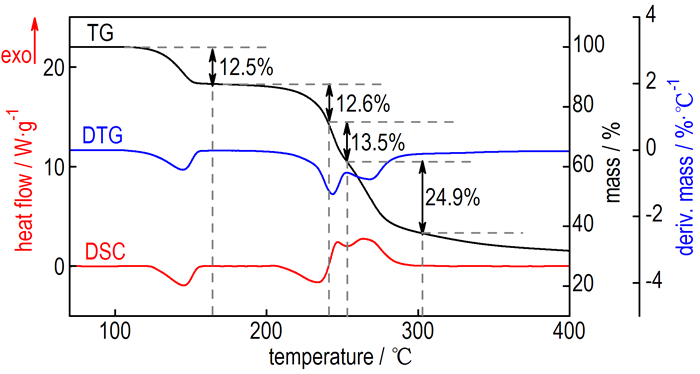
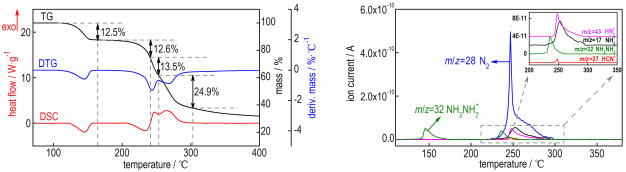
3 结果与讨论 3.1 Hy2BTA热分解特征量及动力学参数Hy2BTA在升温速率β=10 ℃·min-1时的热分解曲线见图 1。从图 1DSC曲线中的峰形变化可以看到该化合物的热分解包括4个过程。其中前两个为吸热过程,峰温分别为144.62 ℃和233.71 ℃,在110~160 ℃和200~240 ℃范围内质量损失率基本一致,分别为12.5%和12.6%;后两个为连续放热过程,峰温分别为246.97 ℃和263.80 ℃,在240~254 ℃和254~300 ℃范围内质量损失率分别为13.5%和24.9%,对应的总放热焓为604.8 J·g-1。此外,Hy2BTA在温度高于400 ℃时仍会剩余质量分数约30%的棕黄色残渣。
|
图 1 Hy2BTA在10 ℃·min-1的TG、DTG和DSC曲线 Fig.1 TG, DTG and DSC curves of Hy2BTA at a heating rate of 10 ℃·min-1 |
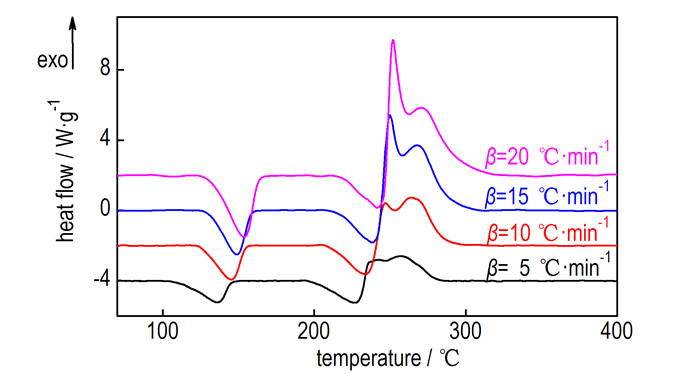
不同升温速率下Hy2BTA的DSC曲线见图 2,各过程对应的热分解数据见表 1。由图 2可见,随着升温速率增加,第1个过程的峰形逐渐变窄,吸热焓基本不变,约为-274 J·g-1; 第2个过程的吸热焓小于第1过程,约为-158 J·g-1,也基本不变; 第3、4两个连续放热过程的总放热焓逐渐减小,其中第3个过程的峰形逐渐变得尖锐,且放热焓在总放热焓中所占比例不断增加,而第4个过程放热焓所占比例逐渐降低。
|
图 2 Hy2BTA在不同升温速率下的DSC曲线 Fig.2 DSC curves of Hy2BTA at different heating rates |
| 表 1 不同升温速率下Hy2BTA的DSC数据 Tab.1 DSC data of Hy2BTA at different heating rates |
采用Coats-Redfern[16]和Kissinger[17]方法分别计算4个过程的表观活化能Ea,所得的动力学参数见表 2。第1个吸热过程,利用Coats-Redfern方法计算125~140 ℃初始分解的表观活化能为143.83 kJ·mol-1,最可几机理函数为一级反应。由于—N—N—的键能为160 kJ·mol-1,高于计算得到的表观活化能[4],且Hy2BTA中四唑环的—N—N—键为共轭结构,键能更高,说明该表观活化能不属于分子中骨架的断裂。取出180℃加热后的样品,发现仍为白色粉末状固体,也说明分子骨架结构没有发生大的变化。质量损失率12.5%与Hy2BTA中一分子肼的含量14.7%较为接近,推测该过程应为Hy2BTA离子键断裂失去一分子肼的过程。失重率和热焓基本不随升温速率改变,进一步说明该过程较单一,符合一分子肼解离的推测。利用Kissinger计算125~140 ℃峰温处的表观活化能为115.12 kJ·mol-1,与Coats-Redfern法计算的表观活化能比较接近,说明第一个吸热分解过程的控制步骤应为一分子肼的失去。
| 表 2 Hy2BTA四个分解过程的动力学参数 Tab.2 Kinetic parameters of four decomposition processes of Hy2BTA |
第2个过程为吸热反应,利用Coats-Redefern方法计算203~230 ℃和230~240 ℃的表观活化能分别为126.71 kJ·mol-1和175.91 kJ·mol-1,最可几机理函数为一级反应,说明该过程仍以裂解反应为主。低温段活化能接近第1个过程,很可能对应于Hy2BTA中第二个离子键断裂再失去一分子肼的过程; 高温段表观活化能明显增大,已高于—N—N—的键能,Kissinger方法计算该过程峰温处表观活化能为193.75 kJ·mol-1,两者均可说明此时四唑环骨架很可能已经开始发生断裂。从Hy2BTA的显微热台图像中(图 3)可以看到,210 ℃和220 ℃时样品的颜色和状态无明显变化,可以说明此时Hy2BTA的基本骨架并未裂解,仅发生离子键的断裂。而从230 ℃开始,固体已开始发黄并出现少量的褐色液痕,240 ℃时,样品的褐色液痕已非常明显,基本可以认为该样品此时已经发生了骨架的断裂,产生了新的物质。

|
图 3 Hy2BTA在10 ℃·min-1和210~240 ℃的显微热台图像 Fig.3 The images of microscope heating stage at 210~240 ℃ of Hy2BTA at a heating rate of 10 ℃·min-1 |
第3个过程为放热反应,利用Coats-Redfern方法计算240~245 ℃的表观活化能为305.98 kJ·mol-1,最可几机理函数为1.5级反应。利用Kissinger计算峰温处的表观活化能为334.16 kJ·mol-1,已经高于—C—N—的键解离能[18](295.81±10.46)kJ·mol-1,说明该过程可能发生—C—N—键的断裂。而随着升温速率的增加,该过程的峰形逐渐变得尖锐,失重率也明显增加,但放热焓却未能增加反而略有降低。一方面源于随升温速率的增加,整个分解过程的反应速率有所提升,使得峰形变得尖锐; 另一方面则由于该过程很可能混有吸热分解过程,高的升温速率有利于此吸热反应的进行,使得失重率及吸热焓增加,进而导致该过程放热焓有所降低。
第4个过程为放热反应,利用Coats-Redfern方法计算256~262 ℃的表观活化能为218.64 kJ·mol-1,最可几机理函数为3级反应。利用Kissinger计算峰温处的表观活化能分别为243.40 kJ·mol-1。可以推测该过程中很可能为剩余骨架复杂的裂解反应。此外,Hy2BTA分解后剩余的棕黄色残渣,可能为分解产物聚合所形成的一些热稳定性较高的含氮聚合物,如:蜜勒胺,蜜白胺和蜜弄[19]。
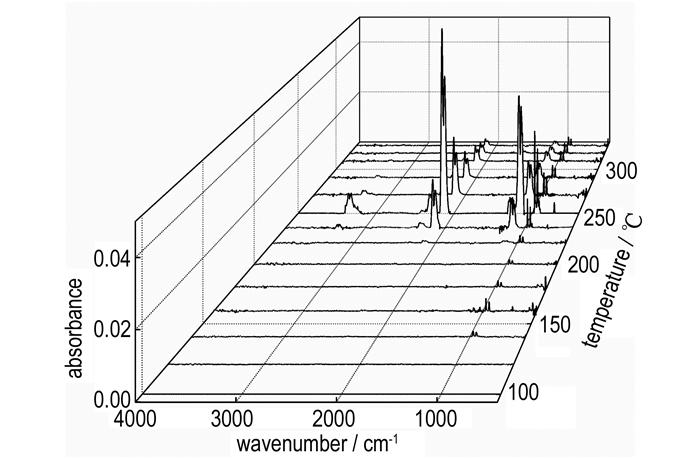
3.2 Hy2BTA热分解产物Hy2BTA热分解的具有红外活性气体产物的红外谱图如图 4所示。图 4中谱峰位置、形状和吸收强度随温度的变化,可以很直观地反映出Hy2BTA随温度升高逐步分解气体产物的种类和含量变化情况。图 5是250 ℃时Hy2BTA气体产物的红外谱图。根据已公开报道的气体红外数据[20],分析图 5中的峰形和振动频率可知,该温度下具有红外活性的气体产物包括: HN3、HCN、NH2NH2及NH3。
|
图 4 在10 ℃·min-1时Hy2BTA随温度升高分解气体产物的红外谱图 Fig.4 IR spectra of the decomposition gas products of Hy2BTA with increasing temperature at 10 ℃·min-1 |

|
图 5 在10 ℃·min-1和250℃时Hy2BTA分解气体产物的红外谱图 Fig.5 IR spectra of the decomposition gas products at 250 ℃ of Hy2BTA at 10 ℃·min-1 |
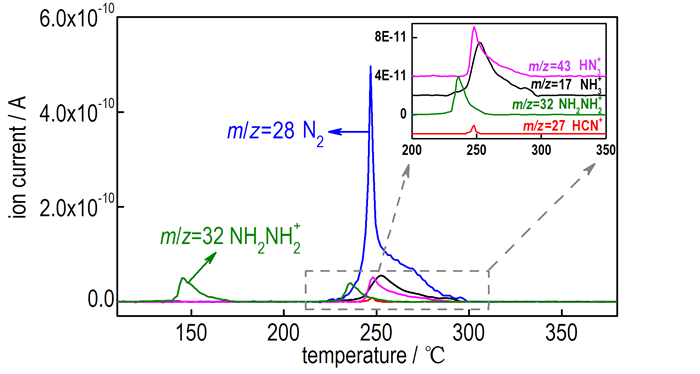
Hy2BTA热分解气体产物的质谱图(图 6)可以清晰地反映它们的含量随温度逐渐升高的变化情况。其中,NH2NH2分两个阶段产生,分别对应于图 1中110~160 ℃和200~240 ℃两个吸热分解过程,因此可以确定Hy2BTA吸热分解是逐步断裂离子键脱除NH2NH2的过程。N2为最主要也是Hy2BTA骨架分解时最先出现的气体产物,从图 6中可以看出在230 ℃左右N2就已经开始出现,证实了200~240 ℃吸热分解过程中存在四唑环的裂解。
|
图 6 在10 ℃·min-1时H2BTA随温度升高分解气体产物的质谱图 Fig.6 MS spectra of the decomposition gas products of H2BTA with increasing temperature of H2BTA at 10 ℃·min-1 |
HN3、NH3、HCN和N2的含量均在Hy2BTA第3个分解过程(240~254 ℃)中出现极大值,说明该过程骨架断裂时,会产生4种气体。其中N2含量最高,这是富氮含能化合物的典型特征; HCN的含量最低,可能是其作为后续聚合反应的反应物所致,此前测定Hy2BTA母体化合物H2BTA的分解时发现,H2BTA剧烈分解(β=50 ℃·min-1)时剩余残渣的质量分数会从缓慢分解的30%降至10%,而HCN的含量则会显著增加,这充分说明HCN很可能参与了后续的聚合反应[21]。
基于Hy2BTA热分解数据、动力学参数、红外及质谱的数据,分析Hy2BTA最可能的热分解机理如Scheme 1所示。
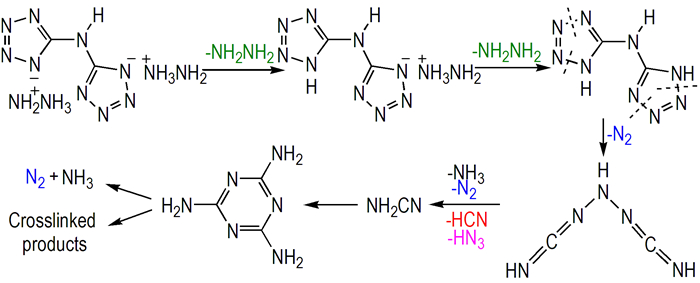
|
Scheme1 The most probable decomposition mechanism of Hy2BTA |
(1) Hy2BTA的热分解表现为4个过程,其中前2个为吸热过程,Coats-Redfern计算其初始分解的表观活化能分别为143.83 kJ·mol-1和126.71 kJ·mol-1,最可几机理函数为一级反应,Kissinger方法计算其峰温处的表观活化能分别为115.12 kJ·mol-1和193.75 kJ·mol-1; 后2个为连续放热过程,Coats-Redfern计算其初始分解放热过程的表观活化能分别为305.98 kJ·mol-1和218.64 kJ·mol-1,最可机理函数分别为1.5级和3级反应,Kissinger方法计算其峰温处的表观活化能分别为334.16 kJ·mol-1和243.40 kJ·mol-1。
(2) 采用TG-DSC-FTIR-MS联用技术,测定了Hy2BTA在热分解过程中产生的气体种类及其含量变化。其中在120~160 ℃检测到了NH2NH2; 210~240 ℃检测到了少量的N2和NH2NH2; 240~250 ℃同时检测到了HN3、NH3、微量HCN及大量N2; 250~300 ℃检测到了N2、NH3和HN3。
(3) Hy2BTA的4个分解过程为:首先在110~160 ℃,分子中第一个离子键断裂失去一分子NH2NH2; 随后在200~240 ℃,第二个离子键断裂失去NH2NH2的过程中,四唑环骨架开始以—N—N—键断裂的方式脱除N2; 然后在240~254 ℃,四唑环及剩余骨架的进一步裂解产生N2、HN3、HCN及NH3; 最后在254~300 ℃,剩余骨架分解产生HN3、N2和NH3,还包括裂解产物的进一步聚合形成棕黄色热稳定性高的含氮高聚物。
| [1] |
Klapötke T M.
New nitrogen-rich high explosives in high energy density materials[M]. 2007: 85-121.
|
| [2] |
Piekiel N, Zachariah M R. Decomposition of aminotetrazole based energetic materials under high heating rate conditions[J].
The Journal of Physical Chemistry A, 2012, 116(6): 1519-1526. DOI:10.1021/jp203957t |
| [3] |
ZHANG Jia-heng, ZHANG Qing-hua, Vo T T, et al. Energetic salts with π-stacking and hydrogen-bonding interactions lead the way to future energetic materials[J].
Journal of the American Chemical Society, 2015, 137(4): 1697-1704. DOI:10.1021/ja5126275 |
| [4] |
Talawar M B, Sivabalan R, Mukundan T, et al. Environmentally compatible next generation green energetic materials (GEMs)[J].
Journal of Hazardous Materials, 2009, 161(2): 589-607. |
| [5] |
黄海丰, 周智明. 基于有机阴离子的含能离子盐研究进展[J].
火炸药学报, 2012, 35(6): 1-10. HUANG Hai-feng, ZHOU Zhi-ming. Progress of study on organic anion based on energetic salts[J]. Chinese Journal of Explosives and Propellants, 2012, 35(6): 1-10. |
| [6] |
田均均, 张庆华, 李金山. 含能分子合成最新进展[J].
含能材料, 2016, 24(1): 1-9. TIAN Jun-jun, ZHANG Qing-hua, LI Jin-shan. Recent advances in energetic molecule synthesis[J]. Chinese Journal of Energetic Materials(Hanneng Cailiao), 2016, 24(1): 1-9. DOI:10.11943/j.issn.1006-9941.2016.01.001 |
| [7] |
李亚南, 舒远杰, 张生勇, 等. 4, 4', 5, 5'-四硝基-2, 2'-联咪唑及其含能离子盐的合成及热性能[J].
含能材料, 2017, 25(4): 298-303. LI Ya-nan, SHU Yuan-jie, ZHANG Sheng-yong, et al. Synthesis and thermal properties of 4, 4', 5, 5'-tetranitro-2, 2'-biimidazole and its energetic ion salts[J]. Chinese Journal of Energetic Materials(Hanneng Cailiao), 2017, 25(4): 298-303. DOI:10.11943/j.issn.1006-9941.2017.04.005 |
| [8] |
梁丽轩, 周智明. 钝感高能含能离子盐的研究进展[J].
火炸药学报, 2014, 37(1): 1-11. LIANG Li-xuan, ZHOU Zhi-ming. Progress of study on insensitive high energetic ionic salts[J]. Chinese Journal of Explosives and Propellants, 2014, 37(1): 1-11. |
| [9] |
王双洁, 管萍, 胡小玲, 等. 基于唑类离子的含能离子盐的研究进展[J].
材料工程, 2015, 43(11): 98-105. WANG Shuang-jie, GUAN Ping, HU Xiao-ling, et al. Research progress in azole-based energetic ionic salts[J]. Journal of Materials Engineering, 2015, 43(11): 98-105. DOI:10.11868/j.issn.1001-4381.2015.11.016 |
| [10] |
黄晓川, 郭涛, 刘敏, 等. 联唑类含能化合物及其含能离子盐研究进展[J].
含能材料, 2015, 23(3): 291-301. HUANG Xiao-chuan, GUO Tao, LIU Min, et al. Review onbis-azoles and its energetic ion derivatives[J]. Chinese Journal of Energetic Materials(Hanneng Cailiao), 2015, 23(3): 291-301. DOI:10.11943/j.issn.1006-9941.2015.03.017 |
| [11] |
毕福强, 樊学忠, 许诚, 等. 不敏感四唑非金属含能离子化合物的研究进展[J].
含能材料, 2012, 20(6): 805-811. BI Fu-qiang, FAN Xue-zhong, XU Cheng, et al. Review on insensitive non metallic energetic ion compound of tetrazolate anions[J]. Chinese Journal of Energetic Materials(Hanneng Cailiao), 2012, 20(6): 805-811. |
| [12] |
彭蕾, 李玉川, 杨雨璋, 等. 双环和多环四唑含能化合物的合成研究进展[J].
有机化学, 2012, 32(04): 667-676. PENG Lei, LI Yu-chuan, YANG Yu-zhang, et al. Research progress in synthesis of energetic compounds of bicyclo-and multicyclo-tetrazoles[J]. Chinese Journal of Organic Chemistry, 2012, 32(04): 667-676. |
| [13] |
Hiskey M A, Chavez D E, Naud D L. Low-smoke pyrotechnic compositions: USP 6214139[P], 2001.
|
| [14] |
GUO Yong, GAO Hai-xiang, Twamley B, et al. Energetic nitrogen rich salts of N, Nbis[1(2)H-tetrazol -5-yl]amine[J].
Advanced Materials, 2007, 19(19): 2884-2888. DOI:10.1002/(ISSN)1521-4095 |
| [15] |
高福磊, 陈斌, 范红杰, 等. N, N二(1(2)氢-5-四唑基)胺及其衍生物的研究进展[J].
含能材料, 2014, 22(5): 709-715. GAO Fu-lei, CHEN Bin, FAN Hong-jie, et al. Progress of N, N'-bis(1(2)H-tetrazol-5-yl) amine and its derivations[J]. Chinese Journal of Energetic Materials(Hanneng Cailiao), 2014, 22(5): 709-715. |
| [16] |
Thomas M K, Michael G, Jörg S. High-nitrogen and high-oxygen explosives as possible replacements for RDX[J].
International Journal of Energetic Materials and Chemical Propulsion, 2011, 10(1): 45-54. DOI:10.1615/IntJEnergeticMaterialsChemProp.v10.i1 |
| [17] |
Coats A W, Redfern J P. Kinetic parameters from thermogravimetric data[J].
Nature, 1964, 201(4914): 68-69. DOI:10.1038/201068a0 |
| [18] |
Kissinger H E. Reaction kinetics in differential thermal analysis[J].
Analytical Chemistry, 1957, 29(11): 1702-1706. DOI:10.1021/ac60131a045 |
| [19] |
罗渝然.
化学键能数据手册[M]. 北京: 科学出版社, 2005: 257.
|
| [20] |
Stoner C E, Brill T B. Thermal decomposition of energetic materials 46. The formation of melamine-like cyclicazines as a mechanism for ballistic modification of composite propellants by DCD, DAG, and DAF[J].
Combustion and Flame, 1991, 83(3-4): 302-308. DOI:10.1016/0010-2180(91)90077-O |
| [21] |
Shimanouchi T. Tables of molecular vibrational frequencies. Consolidated volume Ⅱ[J].
Journal of Physical and Chemical Reference Data, 1977, 6(3): 993-1102. DOI:10.1063/1.555560 |
| [22] |
Fischer G, Holl G, Klapötke T M, et al. A study on the thermal decomposition behavior of derivatives of 1, 5-diamino-1H-tetrazole (DAT): A new family of energetic heterocyclic-based salts[J].
Thermochimica Acta, 2005, 437(1): 168-178. |
The thermal decomposition behavior ofdihydrazinium salt of bis(5-amino-1, 2, 3, 4- tetrazolium) Hy2BTA and its gas products were investigated by TG-DSC-FTIR-MS. The most possible thermolysis mechanism of Hy2BTA was proposed.




