呋咱类化合物因具有高密度、高氮含量、高生成焓和高氧平衡等优点,作为新型高性能含能材料被广泛研究[1-3]。将呋咱结构单元与硝基、偶氮基等含能基团结合,所获得的含能化合物已多达百种,其中典型代表有3, 4-二硝基呋咱基氧化呋咱、3, 3′-二硝基-4, 4′-偶氮氧化呋咱和3, 3′-二硝胺基-4, 4′-氧化偶氮呋咱[4-8]。2016年,Shreeve等通过引入偶氮基和偕二硝基两种高能基团,设计合成出3, 3′-二(偕二硝基甲基)-4, 4′-偶氮呋咱(4)及其含能离子盐等一系列新型含能化合物[9-10]。4的爆速和密度与RDX相当,且氧平衡为12.8%(ΩCO),可作为炸药及推进剂配方中的高氧平衡组分。3, 3′-二(偕二硝基甲基)-4, 4′-偶氮呋咱钾盐(3)的密度为2.039 g·cm-3,理论爆速为8138 m·s-1,爆压为30.1 GPa,撞击感度为2 J,摩擦感度为20 N,具有典型起爆药的特性[9]。
文献[9-10]虽然报道了3和4的结构信息和理论性能,但对合成反应过程的描述较为简略,对一些关键中间体甚至未进行分离表征,而且也未对化合物的热性能进行系统研究。基于此,本研究系统分析了3和4的合成过程及其热性能,借鉴文献报道[9]的反应路线,以3, 3′-二氰基-4, 4′-偶氮呋咱为原料,开展4和3的相关合成研究; 对文献[9]中提及但未确证的物质进行分离、提纯并表征其结构,最终确认为一种尚未见报道的新型呋咱化合物(1),进一步完善了该反应过程研究; 使用1H NMR、13C NMR、IR、质谱及元素分析等手段对化合物结构进行表征,并通过差示扫描量热法-热重法(DSC-TG)研究1、3和4的热行为。
2 实验部分 2.1 试剂与仪器试剂:3, 3′-二氰基-4, 4′-偶氮呋咱,自制[11]; 五氧化二氮,自制[12]; 浓硝酸(98%),分析纯,树德化工; 二氯甲烷,盐酸羟氨,碳酸氢钠,碘化钾,硫酸镁,均为分析纯,西陇化工。
仪器:LC 2010A型高效液相色谱仪(归一化法),日本岛津公司; NEXUS870型傅里叶变换红外光谱仪,美国热电尼高力公司; AV 500型(500 MHz)超导核磁共振仪,瑞士BRUKER公司; 飞行质谱micrOTOF-QⅡ,德国Bruker公司; VARIO EL 3型元素分析仪,德国EXEMENTAR公司; TGA/DSC 2 STARe热分析系统,瑞士Mettler公司。
2.2 实验过程 2.2.1 3, 3′-二偕氨肟基-4, 4′-联氨呋咱(1) 的合成25 ℃下,在带有机械搅拌、温度计及冷凝管的100 mL反应瓶中依次加入50 mL水、3, 3′-二氰基-4, 4′-偶氮呋咱2.2 g(10 mmol)、碳酸钠2.7 g (25 mmol)和盐酸羟胺1.7 g(25 mmol),反应4 h,过滤得1 2.68 g, 收率93.3%,纯度为98.0%。1H NMR(DMSO-d6): δ 10.570 (s,2H),8.231 (s,2H),6.316 (s,4H); 13C NMR(DMSO-d6):δ 156.1,143.7,140.3。IR (KBr,ν/cm-1): 3466,3378,3259,2874,1676,1588,1572,1550,1490,1453,1430,1320,1180,1101,1027,968,924,816,779,750,647,580,539,418。元素分析(C6H8N10O4,%):理论值,C 25.36,H 2.84,N 49.29;实测值,C 25.38,H 2.83,N 49.28。MS(ESI-):m/z=283.134[C6H7N10O-]。
2.2.23 , 3′-二偕氯肟基-4, 4′-偶氮呋咱(2) 的合成0 ℃下,向100 mL反应瓶中依次加入20%盐酸水溶液30 mL和2.68 g(9 mmol)化合物1,搅拌至完全溶解,0 ℃下滴加溶解有亚硝酸钠1.4 g(20 mmol)的水溶液20 mL,滴加完毕后,升温至25 ℃反应2 h,过滤得到2 2.61 g,收率91.2%,纯度为98.2%。1H NMR(DMSO-d6): δ 13.767(s,2H); 13C NMR(DMSO-d6):δ 161.2,147.5,123.8。IR(KBr,ν/cm-1):3345,2058,1703,1616,1543,1485,1402,1384,1269,1236,1036,957,942,919,890,867,742,678,611,568,533,475。元素分析(C6H2Cl2N8O4,%):理论值,C 22.45,H 0.63,N 34.90;实测值,C 22.47,H 0.61,N 34.84。MS(ESI-):m/z=318.951,320.949[C6HCl2N8O4-]。
2.2.3 3, 3′-二偕二硝甲基-4, 4′-偶氮呋咱钾盐(3) 的合成向50 mL反应瓶中加入20%的五氧化二氮硝酸溶液20 mL,搅拌下加入2.61 g(8 mmol)化合物2,控制体系温度不超过5℃,加入完毕后控制在0℃条件下反应20 min,将反应液倒入碎冰中,经二氯甲烷萃取、减压蒸馏等步骤得到黄色油状液体; 在25℃下,向100 mL反应瓶中依次加入甲醇20 mL和黄色油状液体,搅拌至完全溶解,滴加10%(质量百分比)碘化钾甲醇溶液的20 mL,滴加完毕后,25℃条件下反应4 h,过滤得到0.9 g化合物4,收率24.5%,纯度为98.5%。13C NMR(DMSO-d6):δ 162.2,140.9,120.3。IR(KBr,ν/cm-1):3321,1740,1630,1500,1463,1398,1225,1145,1236,1067,997,928,821,746,685。元素分析(C6K2N10O10,%):理论值, C 16.00,N 31.10;实测值,C 15.98,N 31.15。MS(ESI-):m/z=410.942[C6KN10O10-]。
2.2.4 3, 3′-二偕二硝甲基-4, 4′-偶氮呋咱(4) 的合成25 ℃下,向50 mL反应瓶中依次加入50% H2SO4水溶液20 mL和3 0.9 g (2 mmol),加入完毕后,反应4 h,过滤得到4 0.63 g,收率63.1%,纯度为98.7%。1H NMR(DMSO-d6):δ 9.411(s,2H); 13C NMR(DMSO-d6):δ 162.1,140.9,120.3。IR(KBr,ν/cm-1):3441,2897,1740,1604,1474,1399,1385,1343,1304,1289,1260,1123,1056,986,934,919,894,869,820,785,745,702,667,634,625,565,497,429。元素分析(C6H2N10O10,%):理论值,C 19.26,H 0.54,N 42.76;实测值,C 19.29,H 0.55,N 42.76。MS(ESI-):m/z=372.991[C6HN10O10-]。
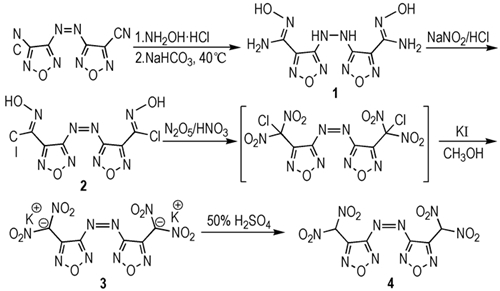
3 结果与讨论 3.1 3, 3′-二(偕二硝基甲基)-4, 4′-偶氮呋咱(4) 的合成反应过程Shreeve等[9-10]以3, 3′-二氰基-4, 4′-偶氮呋咱为原料,经羟氨加成反应得到一种白色固体,但未进行提纯和结构表征,而直接进行重氮化反应得到2。为进一步完善该反应过程的研究,本研究将文献[9-10]报道中提及的白色固体1进行分离提纯及结构表征,最终确证其结构为3, 3′-二偕氨肟基-4, 4′-联氨呋咱。Chavez等[13]详细报道了偶氮呋咱通过与锌粉或肼的还原反应得到联氨呋咱,考虑到羟氨具有与肼类似的还原能力,因此推测在本反应过程中羟氨与氰基发生加成反应的同时,过量的羟氨将偶氮基团还原为联氨基团,生成得到1。继而1的偕氨肟基在盐酸/亚硝酸钠体系中经重氮化反应转变为偕氯肟基,另外盐酸/亚硝酸钠体系产生一定量的二氧化氮,将联氨基团重新氧化为偶氮基团,从而得到2。2在硝酸/五氧化二氮体系中硝化得到一种黄色油状液体,但未能进行分离提纯。根据文献[14]报道的反应机理分析,推测该黄色油状液体的主要成分应为3, 3′-二偕氯二硝甲基-4, 4′-偶氮呋咱。将黄色油状固体直接溶解到甲醇中,与碘化钾发生复分解反应得到3。最后,3在50%的硫酸水溶液中酸化得到4。具体反应过程如Scheme 1所示。
|
Scheme 1 |
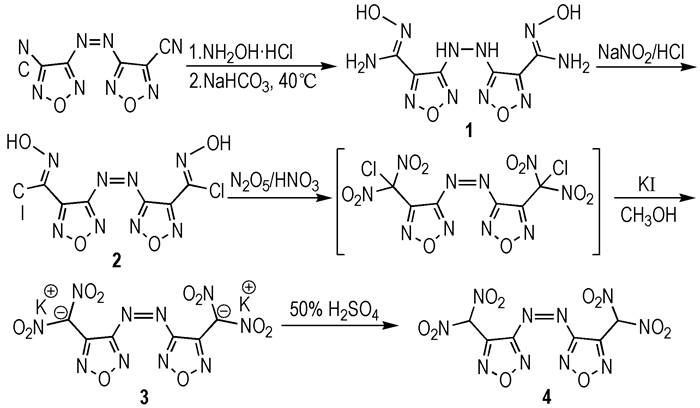
1的红外光谱如图 1所示。根据文献[15-16]的类似化合物的波谱归属以及化合物结构特征,对1的红外吸收谱带进行了相应的归属。3446 cm-1和3378 cm-1可归属为1中—NH2的伸缩振动吸收峰; 3259 cm-1可归属为1中—OH和—NH—NH—发生缔合后形成的宽峰; 1588 cm-1和1572 cm-1归属为—NH2和—NH—NH—的面内剪式振动吸收峰; 1676 cm-1和968 cm-1归属为呋咱环上C=N—O的伸缩振动吸收峰和变形振动吸收峰。以上分析结果表明1含有羟基、氨基、联氨基以及呋咱环等结构单元。
|
图 1 FTIR spectra of compound 1 |
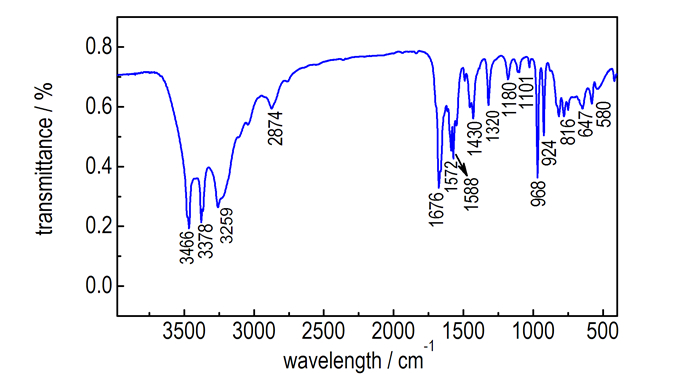
1的H谱及C谱如图 2所示。在1的氢谱中,偕氨肟基上—NH2的化学位移出现在δ 6.316,相对于3-氨基-4-偕胺肟基呋咱的—NH2化学位移向低场移动[15]; 在δ 10.570出现的信号为偕氨肟基的羟基峰,3-氨基-4-偕胺肟基呋咱的羟基信号同样向低场进行一定位移[15]; 以上两组信号的化学位移情况可能要归结受到联氨基团的供电子作用的影响。在δ 8.231出现的信号归属为联氨基上—NH,这与其他相似结构化合物的H谱信号相符[13]。以上三组H谱信号的积分面积的比例为2.06:1:1.03,符合三种基团间氢原子数的比例。在1的碳谱中,在δ 156.1出现的信号归属为偕氨肟基上的碳信号,而呋咱环上两种不同的碳信号分别出现在δ 143.7和δ 140.3,这与其他相似结构化合物的C谱信号相符[13]。
|
图 2 化合物1的H谱和C谱 Fig.2 1H NMR and 13C NMR spectra of compound 1 |
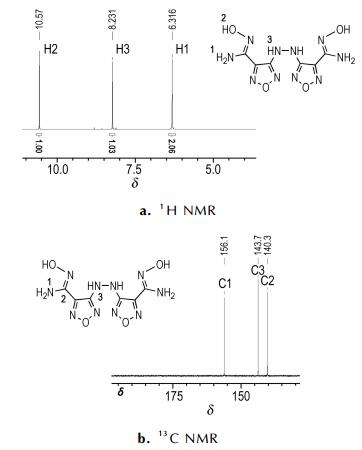
1的ESI源质谱信号的如图 3a所示。其中分子离子峰的m/z为283.1,与1的相对分子质量相符; m/z为567.1的碎片峰归属为两个1的分子耦合后失去一个H的信号; m/z为127.1的碎片峰归属为呋咱环与偕氨肟基耦合形成的分子碎片。1受ESI源激发后的裂解耦合途径如图 3b所示。
|
图 3 化合物1的质谱信号图及裂解耦合途径 Fig.3 Mass spectra and cleavage reaction pathways of compound 1 |
根据以上红外、核磁以及质谱对1的测试分析结果,可以确证1的结构为3, 3′-二偕氨肟基-4, 4′-联氨呋咱。
3.3 1、3和4的热性能样品用量小于0.5 mg,N2流速为100 mL·min-1,样品池为铝制坩埚,升温区间为30~400 ℃下,获得化合物1、3和4的DSC-TG曲线,如图 4所示。由图 4a可知,1在30~400℃的分析区间有三个明显的失重阶段:第一个失重阶段在73.0~96.7℃,失重率为5.1%;第二个失重阶段在214.0~279.8 ℃,失重率为53.5%;第三个失重阶段在279.8~399.8 ℃,失重率为36.3%。1的DSC曲线显示,在73.0~96.7 ℃,214.0~279.8 ℃,279.8~399.8 ℃,分别出现了一个脱结晶水吸热峰和两个分解放热峰,其中脱结晶水吸热峰的吸热量为78.1 J·g-1,初始吸热温度为78.2 ℃,吸热峰值温度为83.7 ℃; 第一个分解放热峰的放热量为1277.1 J·g-1,初始分解温度为233.2 ℃,分解峰值温度为241.1 ℃; 第二个分解放热峰较为扁平,表明该阶段的放热现象较不明显,其峰值温度为336.2 ℃。
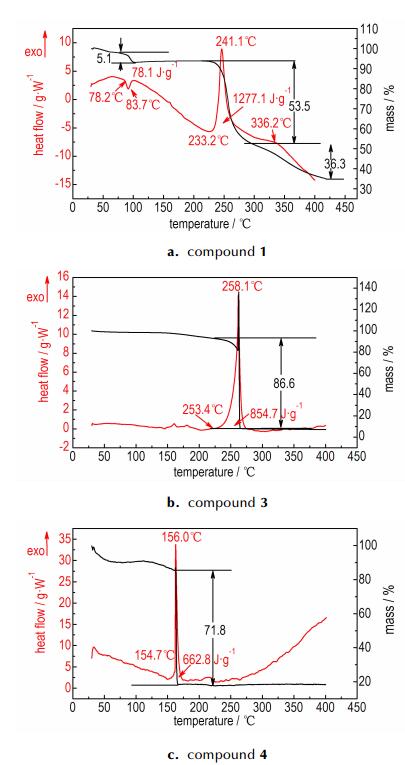
|
图 4 化合物1、3和4的DSC-TG曲线 Fig.4 The DSC-TG curves of compound 1, 3 and 4 |
由图 4b可知,3在30~400 ℃仅有一个明显的失重阶段,失重阶段在226.5~266.1 ℃,失重率为86.6%。DSC曲线显示3在226.5~266.1 ℃有一个分解放热峰,分解放热峰的放热量为854.7 J·g-1,初始分解温度为253.4 ℃,分解峰值温度为258.1 ℃。
由图 4c可知,4在30~400 ℃也只有一个的失重阶段,出现在156.9~172.9 ℃,失重率为71.8%。DSC曲线显示4在156.9~172.9 ℃内有一个分解放热峰,放热量为662.8 J·g-1,初始分解温度为154.7 ℃,分解峰值温度为156.0 ℃。
以上热分析结果表明1和3的热稳定性要优于4。这可能由于1的结构要比4含有更多的氢键,而3的结构中含有离子键[17-18]。
4 结论(1) 以3, 3′-二氰基-4, 4′-偶氮呋咱为原料,经加成、重氮化以及硝化等四步反应得到3, 3′-二(偕二硝基甲基)-4, 4′-偶氮呋咱(4)及其钾盐(3),四步反应的收率分别为93.3%、91.2%、24.5%和63.1%;在反应过程中分离得到一种未见报道的呋咱类化合物,并表征确证其结构为3, 3′-二偕氨肟基-4, 4′-联氨呋咱(1),推测在羟氨与氰基发生加成反应的过程中,过量羟氨同时将偶氮基还原为联氨基,从而生成1。
(2) 1、3和4的热分解过程研究表明:1的热分解包括一个脱结晶水吸热过程和两个热分解放热过程,热失重率分别为5.1%、53.5%和36.3%,吸热峰值温度为83.7 ℃,分解放热峰值温度分别为241.1 ℃和336.2 ℃; 3的热分解过程仅有一个明显的分解放热阶段,热失重率为86.6%,其分解放热峰值温度为258.1 ℃; 4的热分解过程也仅有一个明显的分解放热阶段,热失重率为71.8%,其分解放热峰值温度为156.0 ℃。
| [1] | He C, Tang Y, Mitchell L, et al. N-Oxides light up energetic performances:synthesis and characterization of dinitraminobisfuroxans and their salts[J]. Journal of Materials Chemistry A, 2016, 4(23): 8969-8973. DOI:10.1039/C6TA03619H |
| [2] | Wei H, He C, Zhang J, et al. Combination of 1, 2, 4-oxadiazole and 1, 2, 5-oxadiazole moieties for the generation of high-performance energetic materials[J]. Angewandte Chemie, 2015, 127(32): 9499-9503. DOI:10.1002/ange.201503532 |
| [3] | He C, Shreeve J. Potassium 4, 5-bis (dinitromethyl) furoxanate:a green primary explosive with a positive oxygen balance[J]. Angewandte Chemie International Edition, 2016, 55(2): 772-775. DOI:10.1002/anie.201509209 |
| [4] | Thottempudi V, Yin P, Zhang J, et al. 1, 2, 3-Triazolo[4, 5, -e] furazano[3, 4, -b] pyrazine 6-oxide-a fused heterocycle with a roving hydrogen forms a new class of insensitive energetic materials[J]. Chemistry-A European Journal, 2014, 20(2): 542-548. DOI:10.1002/chem.v20.2 |
| [5] | Li H, Zhao F Q, Wang B Z, et al. A new family of energetic salts based on oxy-bridged bis (dinitromethyl) furazan:syntheses, characterization and properties[J]. RSC Advances, 2015, 5(27): 21422-21429. DOI:10.1039/C5RA00175G |
| [6] |
何金选, 卢艳华, 雷晴, 等. 3, 3'-二硝基-4, 4'-偶氮氧化呋咱的合成及性能[J].
火炸药学报, 2011, 34(5): 9-12. HE Jin-xuan, LU Yan-hua, LEI Qing, et al. Synthesis and properties of high energetic compound 3, 3'-dinitro-4, 4'-azofuroxan[J]. Chinese Journal of Explosives & Propellants,, 2011, 34(5): 9-12. |
| [7] | Zhang J, Shreeve J. 3, 3'-Dinitroamino-4, 4'-azoxyfurazan and its derivatives:an assembly of diverse NO building blocks for high-performance energetic materials[J]. Journal of the American Chemical Society, 2014, 136(11): 4437-4445. DOI:10.1021/ja501176q |
| [8] |
周彦水, 王伯周, 李建康, 等. 3, 4-双(4'-硝基呋咱-3'-基)氧化呋咱合成、表征与性能研究[J].
化学学报, 2011, 69(14): 1673-1680. ZHOU Yan-shui, WANG Bo-zhou, LI Jian-kang, et al. Study on synthesis, characterization and properties of 3, 4-bis(4'-nitrofurazano-3'-yl)furoxan[J]. Acta Chimica Sinica, 2011, 69(14): 1673-1680. |
| [9] | Tang Y, Gao H, Imler G, et al. Energetic dinitromethyl group functionalized azofurazan and its azofurazanates[J]. RSC Advances, 2016, 6(94): 91477-91482. DOI:10.1039/C6RA22007J |
| [10] | Tang Y, He C, Mitchell L, et al. Potassium 4, 4'-bis(dinitromethyl)-3, 3'-azofurazanate:A highly energetic 3D metal-organic framework as a promising primary explosive[J]. Angewandte Chemie, 2016, 128(18): 5655-5657. DOI:10.1002/ange.201601432 |
| [11] |
范艳洁, 王伯周, 周彦水, 等. 3, 3'-二氰基-4, 4'-偶氮呋咱(DCAF)合成及晶体结构[J].
含能材料, 2009, 17(4): 385-388. FAN Yan-jie, WANG Bo-zhou, ZHOU Yan-shui, et al. Synthesis and crystal structure of 3, 3'-dicyano-4, 4'-azofurazan(DCAF)[J]. Chinese Journal of Energetic Materials(Hanneng Cailiao), 2009, 17(4): 385-388. |
| [12] |
姜俊, 陈志强, 吕英迪, 等. 五氧化二氮中的四氧化二氮含量控制研究[J].
化学试剂, 2016, 38(8): 765-767. JIANG Jun, CHEN Zhi-qiang, LÜ Ying-di, et al. Dinitrogen tetroxide content control in dinitrogen pentoxide[J]. Chemical Reagents, 2016, 38(8): 765-767. |
| [13] | Chavez D, Hill L, Hiskey M, et al. Preparation and explosive properties of azo-and azoxy-furazans[J]. Journal of energetic materials, 2000, 18(3): 219-236. |
| [14] | Zhang L, Wang B, Fang X, et al. Synthesis, crystal structure and thermal decomposition of a new energetic potassium salt of bis (dinitromethyl) difurazanyl ether[J]. Chinese Journal of Structure Chemistry, 2014, 33(9): 1353-1359. |
| [15] |
王军, 董海山, 黄奕刚, 等. 3, 4-二氨基呋咱基氧化呋咱的合成[J].
含能材料, 2004, 12(A1): 91-94. WANG Jun, DONG Hai-shan, HUANG Yi-gang, et al. Synthesis of 3, 4-diaminofurazanofuroxan[J]. Chinese Journal of Energetic Materials(Hanneng Cailiao), 2004, 12(1): 91-94. |
| [16] | Tang Y, Zhang J, Mitchell L, et al. Taming of 3, 4-di (nitramino) furazan[J]. Journal of the American Chemical Society, 2015, 137(51): 15984-15987. DOI:10.1021/jacs.5b09831 |
| [17] | Dippold A, Klapötke T. A study of dinitro-bis-1, 2, 4-triazole-1, 1'-diol and derivatives-design of high performance insensitive energetic materials by the introduction of N-oxides[J]. Journal of the American Chemical Society, 2013, 135(26): 9931-9938. DOI:10.1021/ja404164j |
| [18] | Tang Y, Gao H, Mitchell L, et al. Syntheses and promising properties of dense energetic 5, 5'-dinitramino-3, 3'-azo-1, 2, 4-oxadiazole and its salts[J]. Angewandte Chemie, 2016, 128(9): 3252-3255. DOI:10.1002/ange.201600068 |
4, 4′-Bis(dinitromethyl)-3, 3′-azofurazan (4) and potassium 4, 4′-bis(dinitromethyl)-3, 3′-azofurazanate (3) were synthesized from 4, 4′-dicyano-3, 3′-azofurazan through addition, diazotization and nitration. A new furazan, 4, 4′-aminoxim-3, 3′-hydrazinefurazan (1), was obtained in the synthesis process of 4. The intermediates and product were analyzed by 1H NMR,13C NMR,IR and mass spectrum.




