随着武器装备的革新和军事技术的发展, 高能量、低感度、低成本、环境友好、综合性能好的含能材料已成为全世界各含能领域研发的热点[1-2]。吡唑环结构中环张力较大, 含有高能的N—N键、C—N键, 且结构中存在π电子体系, 易于进行硝化、磺化、卤化等亲电取代反应[3-4]。环上硝基基团的引入, 使其密度和氮含量增加, 氧平衡更接近于理想值, 从而改善化合物的爆轰性能。其中3, 4, 5-三硝基吡唑作为重要的硝基吡唑类化合物之一, 具有高密度、高能量、低感度的优点, 在含能材料领域具有广阔的应用前景。
3, 4, 5-三硝基吡唑(3, 4, 5-trinitro-1H-pyrazole, TNP, 1)是唯一全碳硝化的吡唑类化合物, 其分子结构式见图 1。TNP为一种白色固体, 不吸湿, 易溶于水及乙醚、乙酸乙酯等有机溶剂。TNP的熔点为187.8 ℃, 密度1.87 g·cm-3, 爆速9.0 km·s-1, 爆压37.09 GPa, 热分解范围为260~350 ℃, 具有良好的热稳定性和化学稳定性[5]。TNP的晶体结构为单斜晶系, 空间群为Pc2/c, 晶胞参数为a=22.5218(9) Å, b=8.2885(3) Å, c=15.1944(6) Å, V=2167.68(14) Å3, Z=12。
3, 4, 5-三硝基吡唑结构(图 1)中含有3个硝基, 其强吸电子作用使得1号位上N原子电负性增大, N—H键可以与C、N或O去质子化的阴离子发生中和反应或复分解反应, 从而形成N质子化的阳离子例如铵、肼、胍、唑、嗪鎓等, 以及其他K+、Ag+、Ba2+、Sr2+等含能盐, 也可通过氢键诱导引入唑类骨架的多样官能团或富氮杂环, 形成高能量密度材料。3, 4, 5-三硝基吡唑及其衍生物可广泛应用于农药、医药、染料、含能材料等领域[6], 具有深远的研究意义和广阔的发展前景。

|
图 1 3, 4, 5-三硝基吡唑分子结构 Fig.1 The molecular structure of 3, 4, 5-trinitro-1H-pyrazole[5] |
2009年, Herve等[7]在12届NTREM会议上首次报道了TNP以及其三种合成方法, 使得TNP及其衍生物的合成研究成为热点。国外已对此类含能化合物进行了大量的研究, 但目前国内外尚未有较全面的综述。因此, 本文系统综述了TNP及其相关衍生物(包括共价型衍生物和含能离子盐)的合成方法、理化性能及其应用, 讨论了以TNP为骨架的新型含能化合物的分子设计, 以期为今后的研究提供一定理论基础。
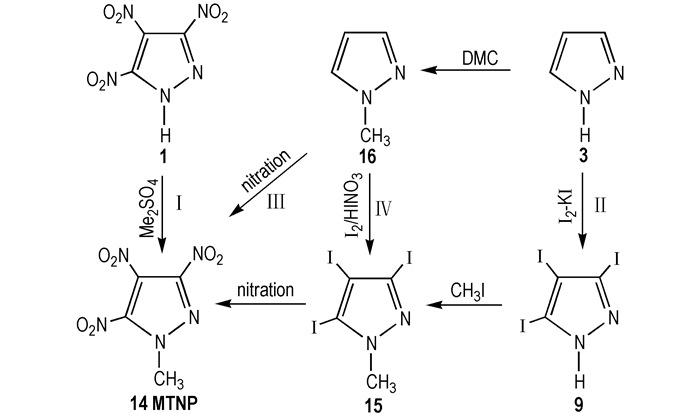
2 3, 4, 5-三硝基吡唑的合成 2.1 直接硝化法直接硝化是指利用硝化剂直接将硝基引入有机化合物分子中, 而不经过其他氧化、加成等其他基团转换方式合成硝基化合物的反应[8], 此方法合成路线见Scheme 1。
Herve等[5]以3, 5-二硝基吡唑(2)采用硝酸/20%发烟硫酸硝化体系, 温度控制在100 ℃, 1H NMR监测反应过程, 合成了TNP, 得率为94%。Dalinger等[9]采用硝化能力稍弱的硝硫混酸体系, 在90~100 ℃下反应10 h得到TNP, 得率为87%。
Ravi等[10-11]提出了金属硝酸盐硝化体系, 并对硝化合成TNP的工艺进行了大量的研究。Ravi分别采用硝酸鉍/二氧化硅、硝酸鉍/硫酸/二氧化硅、蒙脱石K10/硝酸鉍三种硝化体系, 将2与各硝化剂溶在四氢呋喃溶液中, 室温下分别搅拌3, 3, 2.5 h后, 过滤并旋蒸除去溶剂制得TNP, 得率分别为93%、98%和95%。此法比前面提及的方法得率高, 且有效避免了废酸的处理, 方法中提到的硝酸鉍廉价易得, 性质优良, 可适用于芳香杂环化合物的硝化。
除硝酸鉍/二氧化硅外, Ravi还提出硝酸银/三氟化硼、硝酸铜/黏土、硝酸铁/黏土等硝化体系。常用的传统硝化剂有硝酸/硫酸, 硝酸/发烟硫酸, 硝酸/醋酸酐, 硝酸/三氟乙酸酐等体系, 但这些硝化剂在操作时间、介质酸性、硝化能力、热重排、安全问题等方面都存在一定的局限性。相比传统的硝化体系, 金属硝酸盐硝化体系避免了反应介质的酸性问题, 条件温和, 操作简化, 时间明显缩短, 得率提高, 符合绿色化学的研究方向。
由吡唑直接硝化合成TNP, 理论[12]上可能的合成方法有以下五种:分别由吡唑(3)、3-硝基吡唑(4)、4-硝基吡唑(5)、化合物2、3, 4-二硝基吡唑(6)合成TNP, 见Scheme 1, 但是目前已报道文献中除方法Ⅰ成功合成出TNP外, 其他方法均未见报道。
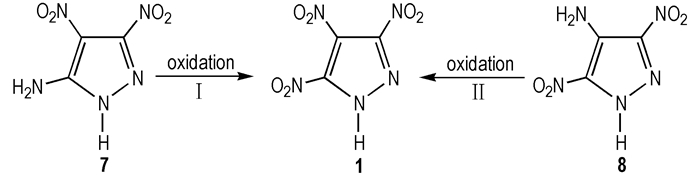
2.2 间接硝化法 2.2.1 氨基氧化法此法主要是以5-氨基-3, 4-二硝基吡唑(7)[13]和4-氨基-3, 5-二硝基吡唑(8)[14]为原料, 氧化合成TNP, 合成路线见Scheme 2。由于化合物7和8吡唑环上两个硝基的强吸电子作用, 使得其氨基高度失活, 需要强氧化剂才能对其氧化。氧化剂主要有硫酸/过氧化氢, 过二硫酸, 过硫酸氢钾等。
|
Scheme 2 Oxidation of aminodinitropyrazoles to obtain TNP[5] |
Herve等[5]以7为原料, N2保护下, 浓硫酸和90%过氧化氢为氧化剂, 二氯甲烷作为溶剂, 合成了TNP, 得率仅为37%。Dalinger等[15]将7溶在92%硫酸中, 然后在0~5 ℃逐滴加入84.5%过氧化氢溶液, 20~30 ℃下加热8 h, 反应结束后, 将反应液倒入冰中, 乙醚多次萃取, 硫酸镁干燥, 真空浓缩得到TNP, 得率同样很低, 仅为42%。两种方法均需要高浓度过氧化氢溶液, 危险系数较高, 还需N2保护, 操作繁琐, 不宜采用。
Herve等[5]以8为原料, 和上述氧化7的合成方法相同, 合成了TNP, 得率明显提高, 为93%, 但不足之处仍为危险系数高的90%过氧化氢。Shreeve等[16]将8溶到浓硫酸中, 冰浴下缓慢滴加30%过氧化氢, 反应24 h, 反应结束后, 冰水稀释, 乙醚反复萃取, 硫酸镁干燥, 真空除去溶剂, 得率93%。此法采用30%过氧化氢, 反应条件温和, 在高产率合成TNP的同时, 显著提升操作的安全性。赵秀秀等[17]仍以8为原料, 舍弃了传统的浓硫酸/过氧化氢氧化体系, 采用过硫酸氢钾为氧化剂, 40 ℃下在水中反应18 h制得TNP, 得率85%, 此法氧化剂绿色环保, 反应时间缩短, 且保证了收率。
传统的氧化方法存在以下缺陷:反应条件苛刻、选择性差、副产物较多、尤其是高浓度过氧化氢/硫酸体系、危险系数极高、金属催化剂昂贵、毒性有机溶剂等。而上述方法中过硫酸氢钾, 原料廉价易得, 绿色环保, 条件温和, 可作为绿色氧化剂使用, 有着更好的应用前景。
从Scheme 2中看, 相比7中5号位的氨基, 8中4号位氨基电子云密度和空间位阻较大, 能够促使分子间氧化反应的进行, 同时有效避免分子间副反应的发生, 氧化选择性强, 路线Ⅱ比路线Ⅰ得率较高。此外, 化合物8中“NO2--NH2--NO2”框架使得其比7更加稳定, 而且容易合成。综合考虑, 路线Ⅱ为TNP典型的合成方法。
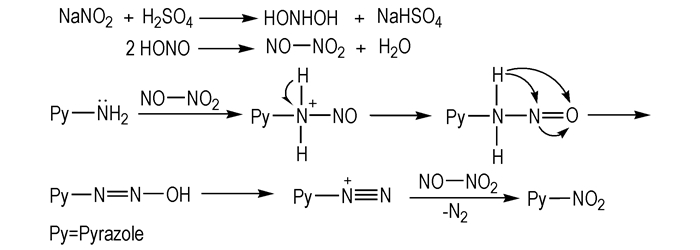
2.2.2 氨基重氮化法带氨基侧链的唑类化合物, 可在强酸介质和亚硝酸的作用下发生重氮化反应, 从而引入硝基, 得到相应的硝基衍生物。重氮化试剂为亚硝酸, 通常由盐酸或硫酸与亚硝酸钠反应制得。由于亚硝酸不稳定, 容易分解, 反应时需临时配样, 及时反应, 且在酸性介质下进行, 通常伯胺与酸的摩尔比为1:2.5。氨基吡唑类化合物重氮化合成TNP的机理见Scheme 3[18]:
|
Scheme 3 Diazotization mechanism of aminodinitropyrazole[18] |
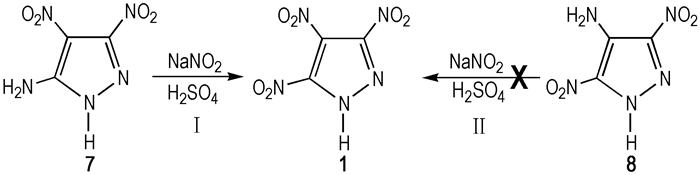
Herve等[8]以7为原料, 通过重氮化法成功制得TNP, 合成路线见Scheme 4。具体做法如下:将7溶于20%硫酸中, 在0~10 ℃下将部分亚硝酸钠滴入其中, 搅拌1 h。然后在20 ℃下将另一部分10%亚硝酸钠水溶液加入上述溶液中, 加热30 min直至氮气放出。浓硫酸中和, 乙酸乙酯萃取, 硫酸镁干燥, 真空浓缩得到TNP, 收率80%。然而, Herve以8为原料, 用类似的方法并未合成出TNP, Herve认为4-重氮基-3, 5-二硝基吡唑的4号位不能发生亲核取代致使方法Ⅱ无法进行。
|
Scheme 4 Diazotization of aminodinitropyrazoles to obtain TNP[5] |
碘容易取代唑环上的氢, 也易被其他亲核试剂取代。此法通过先碘代再硝化的方法制备合成了TNP。通常吡唑环碘代物的硝化机理为:亲电基团NO2+与吡唑环形成络合物, 首先取代吡唑环中电子云密度最大的4号位, 由于NO2+共轭效应的增强, 导致C— I键减弱, C—NO2+增强, 最终解离出I+离子, 形C—NO2键, 见Scheme 5[19]。通常碘代硝化法选择性较高, 易硝化, 条件温和。
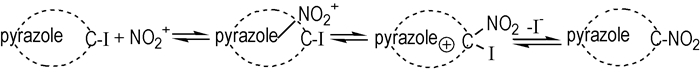
|
Scheme 5 Nitration mechanism of iodopyrazole[19] |
2012年, Ravi等[20]经硝酸硝化3, 4, 5-三碘吡唑(9), 采用碘代硝化法制得TNP, 合成路线见Scheme 6。该法是以吡唑为原料, 碘/碘化钾为碘化剂, 在25%氨水中搅拌24 h, 硫酸氢钠脱色, 过滤, 乙酸酸化, 得到中间产物9, 然后将9用浓硝酸在100 ℃下回流加热40 min, 反应结束后, 倒入冰中, 碳酸氢钠中和, 调PH至0.5, 乙醚反复萃取, 硫酸镁干燥, 得到TNP, 收率86%
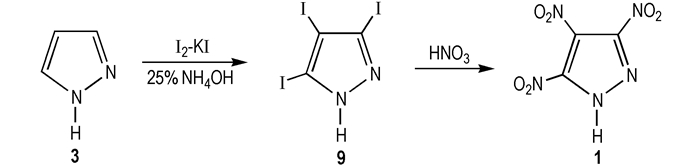
|
Scheme 6 Nitrodeiodination of polyiodopyrazoles to obtain TNP[20] |
此法提出了吡唑环上的全碳卤代, 使得由吡唑环先卤代再硝化合成TNP的方法成为了可能, 为TNP的合成开辟了新的途径。然而此方法提到的碘代得率非常低, 仅为42%, 且碘化剂I2, KI价格昂贵, 反应过程中有废酸产生, 此方法合成TNP存在局限性。其他卤素原子如Cl, Br, 都未曾见报道用此类方法成功合成出TNP。
2.3 微波重排法相比前面提及的三种合成方法, 微波重排法是一种全新且简易的加热合成方法。微波独特的内加热方式, 使反应具有时间短、副反应少、得率高、操作方便、环境友好等优点, 克服了传统加热方法时间冗长, 操作麻烦的缺点, 对有机合成的发展具有重大的推动作用[21]。
Ravi等[22]运用微波法分别以1, 3, 4-三硝基吡唑(10)和1, 3, 5-三硝基吡唑(11)为原料, 无溶剂加热重排合成了TNP, 合成路线见Scheme 7。微波反应条件为:反应温度120~190 ℃, 功率400 W, 反应时间仅为5 min, 得率分别为43%和45%。

|
Scheme 7 Microwave methods for synthesis of TNP[22] |
化合物10, 11和TNP, 三者互为同分异构体。化合物10由5经TFAA(二氯甲烷为溶剂)或NO2BF4(乙腈为溶剂)硝化合成制得[13, 23]。重排加热过程中, N原子上的硝基基团发生异构化。在适宜的溶剂和温度下, N—NO2重排形成更稳定的C—NO2。Ravi仅指出了路线Ⅰ的微波重排机理, 见Scheme 8, 但并未指出11的合成方法以及路线Ⅱ的重排机理。

|
Scheme 8 Rearrangement mechanism of 1, 3, 4-TNP to obtain TNP[22] |
重排反应是有机合成重要的一类反应。重排反应的效果极易受溶剂、时间、温度的影响。硝基吡唑类化合物常用的重排溶剂为氯苯、硝基苯、苯甲醚、二甲苯、均三甲苯、正癸烷、N-甲基甲酰胺、丙二醇或苄腈等[22]。相比溶剂加热重排法, 无溶剂微波重排法明显缩短反应时间, 避免以往重排反应溶剂的减少、处理、循环等问题, 但仅限用于实验室研究, 无法放大工艺满足工业化生产。
在上述7种合成TNP的方法中, 2的直接硝化法和8的氨基氧化法, 是目前研究最多, 最为典型的两种合成TNP的方法, 但2和8的合成步骤较为繁琐, 因此需要继续探索TNP新的合成及优化工艺。而金属硝酸盐硝化体系, 以及文章未提到的N2O5体系[24]、过硫酸氢钾氧化体系等都有很大的发展前景。
3 TNP共价型衍生物的合成、性能及应用 3.1 1-氨基-3, 4, 5-三硝基吡唑1-氨基-3, 4, 5-三硝基吡唑(ATNP, 12)为白色固体, 熔点130.5 ℃, 分解温度范围为176~272 ℃。王军等[25]运用Brinkley-Wilson法则, Rothstein和Kamlet方法等对该炸药的爆炸特性参数进行了计算, 结果如下:密度1.917 g·cm-3、爆速9.17 km·s-1、爆压40.94 GPa。
Herve等[5]在氮气保护下, 冰水浴下将氢化钠加入溶有TNP的无水乙腈中, 温度控制在室温, 向其加入2, 4, 6-三硝基苯基羟胺(Pic-O-NH2)并搅拌3天, 反应结束后过滤, 蒸干滤液, 二氧化硅纯化, 得到粗产品ATNP, 得率仅为26%, 合成路线见Scheme 9。

|
Scheme 9 Synthetic route of ATNP[5] |
1-甲基-3, 4, 5-三硝基吡唑(MTNP, 14)为淡黄色固体, 微溶于水, 易溶于有机溶剂。其熔点91.5 ℃、密度1.81 g·cm-3、爆速8.65 km·s-1、爆压33.7 GPa、分解温度范围为248~280 ℃, 可作为熔铸炸药。Dalinger等[26]研究了其单晶结构, 空间结构为:MTNP属斜方晶系, 空间群为Pn2(1)/c; 晶胞参数为a=11.919(5) Å, b=8.352(3) Å, c=8.477(3) Å, V=843.9(6) Å3, Z=4。MTNP相关合成路线见Scheme 10。
Dalinger等[26]将TNP溶在碳酸氢钠溶液中, 硫酸二甲酯为甲基化试剂, 20 ℃下反应7 h, 首次得到粗产品MTNP, 收率为95%(路线Ⅰ)。
Ravi等[20]以吡唑为原料, 碘/碘酸/乙酸为碘化剂, 先合成中间体9, 然后用碘甲烷甲基化9合成1-甲基-3, 4, 5-三碘基吡唑(15), 再硝酸硝化获得目标产物MTNP(路线Ⅱ)。
Ravi等[27-28]又直接以1-甲基吡唑(16)为原料, 分别以硝硫混酸、蒙脱石K10/硝酸鉍为硝化剂, 一步法直接硝化合成MTNP(路线Ⅲ)。郭俊玲等[29]同样以16为原料, 超酸体系(发烟硫酸/硝酸钾)一步法合成MTNP, 得率15%(路线Ⅲ)。李雅津等[30]借鉴路线Ⅱ, 仍以16为原料, 通过改变碘、碘酸、乙酸的加料顺序, 先合成中间体15, 最终经硝酸硝化制得MTNP, 产率为10%(路线Ⅳ)。
对比上述4种合成MTNP的方法, 路线Ⅰ需要以TNP为原料, 如前所述合成TNP的步骤繁多, 制约着下一步甲基化, 且甲基化试剂为毒性的硫酸二甲酯。路线Ⅱ中9的合成产率较低, 影响着后续步骤产物的合成。路线Ⅲ原料易得, 工艺简单, 但产率较低。路线Ⅳ碘代过程中有废酸生成, 污染严重, 且产率较低。此外, Ⅱ和Ⅳ中碘化剂价格昂贵, 成本太高。综合考虑, 积极寻求路线Ⅲ的优化工艺是合成MTNP的较佳选择。
3.3 1, 3, 4, 5-四硝基吡唑若将TNP的1号位转化为硝基, 可获得新型的含能化合物1, 3, 4, 5-四硝基吡唑(17), 结构式见图 2, Ravi等[31]通过Gaussian 03量子化学软件对化合物17各参数进行了计算和分析。其中密度2.06 g·cm-3、爆速9.24 km·s-1、爆压41.27 GPa、生成热5.60 kJ·kg-1。17与TNP、RDX和HMX相比, 其密度、爆速和爆压明显增加, 爆轰性能出色, 可作为潜在的含能化合物, 但目前尚未有文献报道其合成方法。
部分TNP共价型衍生物与常见炸药的性能比较如表 1所示。从表 1中看, TNP以及其共价衍生化合物均具有较高的密度, 均在1.80 g·cm-3以上, 其爆速均高于6.85 km·s-1, 爆压均高于21.0 GPa, 爆轰性能明显优于TNT。化合物14的爆轰性能与RDX相当, 且熔点更低, 是一种良好的熔铸类炸药载体。TNP与HMX爆轰性能基本相当, 而化合物12和17的密度均大于1.90 g·cm-3、爆速高于9.10 km·s-1、爆压超过40.0 GPa, 三项指标明显优于HMX, 三者均可替代HMX作为潜在的高能单质炸药。国外对TNP和化合物14 的合成、热稳定性和化学稳定性进行了大量的探索和研究, 而对更高性能的化合物12和17的合成鲜有报道, 国内仅对化合物14的合成以及基本物性参数进行了研究。因此, 加大对TNP及相关共价衍生物的探索与研究有一定的现实意义。
| 表 1 部分TNP共价型衍生物与常见炸药的性能比较[25, 31-32] Tab.1 Comparison of the performances of several covalent derivative compounds and common explosives[25, 31-32] |
基于唑类环独特的立体结构和空间效应, 大多数硝基唑类化合物都呈酸性[5]。TNP 1号位N—H键容易与碱发生中和反应, 或与某些金属盐发生复分解反应, 进而引入金属离子, 形成TNP含能金属盐。Drukenmuller等[33]报道并合成了部分以TNP为母体的金属盐, 合成路线见Scheme 11。这些金属盐的合成方法基本相似, 具体方法为:将TNP溶解在溶剂中(常用乙醇), 按化学反应计量逐批加入相应的碱或金属碳酸盐, 室温下搅拌12 h, 反应结束后除去溶剂, 得到相应的TNP金属盐。

|
Scheme 11 Synthesis of metal 3, 4, 5-trinitro-1H-pyrazole salts[33] |
Drukenmuller等通过DSC测试记录部分TNP金属盐的热性能数据, 也通过BAM感度测试仪器列出相关感度数据, 如表 2所示。从表中可以看出除20为193 ℃外, 其他三种TNP金属盐的分解温度均在200 ℃以上, 稳定性较好。金属盐18和21撞击感度为5 J, 属于敏感性, 而金属盐19和20撞击感度为40 J, 属于低感型, 而这四种金属盐的摩擦感度在80~360 N范围内, 属于敏感型。
烟火技术作为含能材料的重要分支[34], 广泛应用于军事照明和民用烟花材料研究中。新型烟火技术的重点在于无烟、微烟及低污染药剂的研发。不同唑类金属盐燃烧发生不同的焰色反应, 燃烧过程中无烟或低烟, 可以提升颜色的色彩。TNP金属盐的燃烧物主要是无毒无害的N2, 无毒害气体释放, 符合环境环保友好的要求。TNP金属盐作为唑类金属盐的一类, 可作为理想的着色剂候选化合物, 在烟火技术应用方面有重大的潜能。
4.2 TNP含能非金属盐吡唑环上的1号位N原子易被质子化作用形成其对应的阴离子, 再与氨、肼、胍、唑、嗪鎓等作用形成非金属含能离子盐。Shreeve等[16]报道了由TNP唑环阴离子和富氮阳离子组成的含能非金属盐的合成, 这些非金属盐包括铵盐, 胍盐, 氨基胍盐, 二氨基胍盐、三氨基胍盐等, 具体路线见Scheme 12。具体操作方法:按照化学反应计量, 将相应的反应物加入到溶有TNP水溶液中, 室温下搅拌, 直至变成透明溶液, 否则继续添加水, 结束后蒸掉多余水分, 得到相应的TNP非金属盐23~30;将含有富氮阳离子的卤素盐溶液逐滴加入到TNPAg悬浮液中, 室温搅拌6 h, 然后过滤AgX(X为Cl或I)沉淀并水洗, 可得到相应的TNP非金属盐31 ~ 35。所有合成的TNP非金属盐23~35, 均不吸湿, 能够在空气中稳定存在。
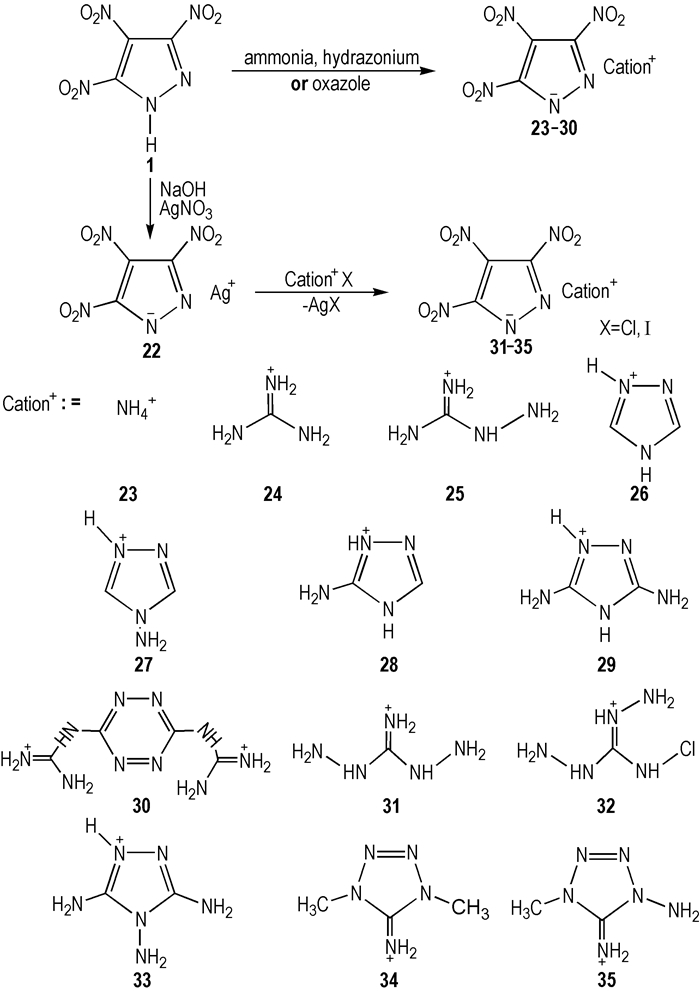
|
Scheme 12 Synthesis of nonmetal TNP salts[16] |
Shreeve等[16]对TNP非金属盐的物理性能进行计算及测试, 相关物性参数见表 3。其中熔点、分解温度、由TG-DSC综合分析仪测出; 密度由气体比重瓶测出; 其他重要参数如生成焓、氧平衡、爆压、爆速、比冲量由Gaussian 03量子化学软件计算得出; 撞击感度用10 kg落锤BAM打桩锤装置测得。
| 表 3 TNP非金属盐与常见炸药的性能比较[16, 32] Tab.3 Comparison of the properties of nonmetal 3, 4, 5-trinitro-1H-pyrazole salts and common explosives[16, 32] |
从表 3可以看出, TNP非金属盐具有较高的密度(1.6~1.8 g·cm-3), 除盐23, 30无熔点, 盐33熔点为206 ℃外, 其他大部分盐熔点范围都在122~188 ℃, 分解温度范围为167~243 ℃, 稳定性良好。除盐23, 24, 25外, 其他盐生成焓在200 kJ·mol-1之上, 盐31甚至达到769 kJ·mol-1。在爆轰性能方面, 这些TNP非金属盐的爆速范围为7.59~8.54 km·s-1, 均超过6.85 km·s-1, 爆压范围为24.3~31.9 GPa, 均超过21.0 GPa, 爆轰性能明显优于TNT, 但爆速均低于8.75 km·s-1, 爆压低于33.8 GPa, 仍逊色于RDX, HMX, 此类盐可作为潜在的TNT替代品。盐27爆速为8.54 km·s-1, 爆压为31.9 GPa, 撞击感度高于40 J, 爆轰性能和感度接近于TATB; 在感度方面, 这些盐的撞击感度高于40 J(除35为35 J外), 均低于TNT(IS为15 J), 属于不敏感型含能盐, 可作为低感型含能材料; 这些TNP非金属盐的比冲量范围为228~269.6 s, 其中23和27的比冲值均大于250 s, 也可以作为潜在的火箭推进剂材料。
传统的富氮含能化合物中高氮低碳氢含量的元素含量特性, 既增加化合物密度, 又易趋于氧平衡。但这类高爆压、高爆速、高爆热的炸药, 除存在着许多单质炸药固有的熔点高、机械感度高、粘接性差、压装困难的问题外, 同时在生产、储存、运输过程中的安全可靠性较差[35]。TNP非金属含能盐作为富氮含能化合物, 不仅具有较高的密度和优良的爆轰性能, 而且熔点和感度较低, 将有效的改善单质炸药存在的上述缺陷, 而且该类化合物燃烧或爆炸后分解产物主要是氮气, 具有低信号和环境友好的特征, 有望广泛应用在高能炸药、推进剂、气体发生剂、烟火剂等领域。
5 TNP为骨架的含能化合物的分子设计 5.1 新型含能化合物的设计理念含能材料作为武器装备系统实现高效毁伤的最终能量载体, 是决定武器先进性的关键因素之一。新型含能材料的研发主要分为分子、晶体、配方三个层面, 尤其是高能单质含能分子的研发占核心地位[36]。新型含能化合物的分子设计, 无论是共价型还是离子型, 都要考虑化合物结构与物理性能、热力学性质、及能量性质等之间的关系[37]。新型含能化合物的关键特性包括C/H/N比, 密度、生成热、氧平衡、感度(撞击、摩擦、静电火花)、爆轰性能、热和水解安定性、环境相容性。其中密度和生成热都是衡量化合物能量高低的关键指标。理想的含能化合物的特性:爆速>8.5 km·s-1、分解温度>200 ℃、撞击感度>7 J、摩擦感度>120 N、与粘合剂和增塑剂相容、在水中溶解度低、能够长期贮存至少15年、分解产物符合环保要求、合成得率高、成本低[38]。
5.2 TNP为骨架的含能化合物的分子设计3, 4, 5-三硝基吡唑作为全碳硝化的唑类化合物, 是合成许多HEDMs的理想中间体[39], 但是其强酸性严重限制其在实际中的应用。随着含能材料技术的不断深入, 人们通过对化合物母体进行修饰和改性, 形成能量高, 稳定性良好的新型含能化合物。这样在增加TNP母体爆炸能量的同时, 也降低其酸性, 更容易拓宽其应用范围。主要途径有两种:
一是以TNP唑环为骨架, 用苦基、硝氨基, 偶氮基, 氧化偶氮基、唑环等含能基团取代1号位上的H, 尽可能构建高氮含量的桥连骨架或共轭平面, 形成共价型含能化合物。这些化合物还可通过修饰引入更多的C—N键、N—N键、N=N键以及—NO2、—CN、—N3、—NH2等基团, 从而增加化合物的密度和生成热, 降低碳氢含量, 更容易趋于氧平衡。还可通过N-硝胺化、N→O化定向调控, 在改进分子能量和感度的同时, 提高分子设计的多样性和可靠性。这样既增加TNP母体的爆炸能量, 也降低其酸性并拓宽其应用范围。
王军等[25]设计出一系列TNP为骨架的含能化合物分子, 其结构见图 3, 性能计算结果见表 4。从表 4看出, 除36密度为1.85 g·cm-3, 37~40密度均在1.9 g·cm-3之上; 爆轰性能方面, 36性能略低于RDX, 40与RDX相当, 37优于RDX, 而38和39爆速均高于9.10 km·s-1, 爆压均高于41 GPa, 尤其38高达46 GPa, 二者均可替代HMX, 成为新型高能单质炸药。
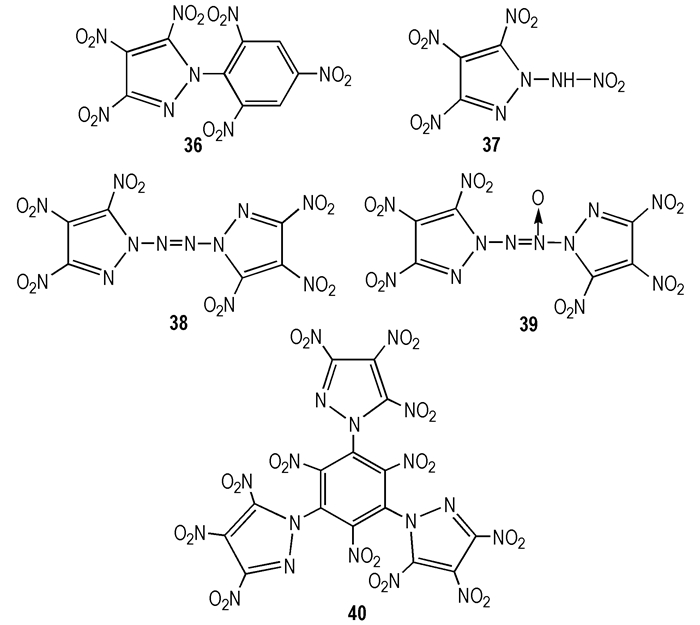
|
图 3 TNP为骨架的含能化合物分子结构 Fig.3 The molecular structure of energy compounds based on TNP[25] |
二是以TNP唑环为阴离子骨架, 引入富氮阳离子基团, 形成离子型含能化合物。Yin等[40]将TNP唑环阴离子与三唑环阳离子结合, 设计并合成了含能离子盐41, 其结构式见图 4。该化合物密度1.87 g·cm-3、爆速8.36 km·s-1、爆压28.3 GPa、摩擦感度为360 N、撞击感度为40 J。41爆轰性能与RDX相当, 感度很低, 可作为潜在的钝感炸药。
6 结论与展望综述了TNP及其衍生物(共价型衍生物、金属盐、非金属盐)的合成方法, 相关性能及应用情况。基于低的撞击感度, 良好的稳定性, 高的爆轰性能, TNP及其衍生物可作为潜在的候选含能材料。目前TNP及其衍生物的研究已经取得一定的成果, 但仍留有许多方向需要继续开拓、探索和研究。笔者认为今后应当注重以下几个方面的研究:(1)TNP新的合成工艺及优化; (2)TNP共价型衍生物, 如1, 3, 4, 5-四硝基吡唑(ATNP)的合成及性能研究; (3)以TNP为骨架, 与其他富氮基团构建的新型含能化合物的分子设计及合成研究; (4)TNP及其衍生物的实际应用研究。
| [1] |
Yu Z, Bernstein E R. Sensitivity and performance of azole-based energetic materials[J].
The Journal of Physical Chemistry A, 2013, 117(42): 10889-10902. DOI:10.1021/jp4054007 |
| [2] |
黄辉, 王泽山, 黄亨建, 等. 新型含能材料的研究进展[J].
火炸药学报, 2005, 28(4): 9-13. HUANG Hui, WANG Ze-shan, HAUNG Heng-jian, et al. Rsearches and progresses of novel energetic materials[J]. Chinese Journal of Explosives & Propellants, 2005, 28(4): 9-13. |
| [3] |
赵廷兴, 李磊, 董战, 等. 硝基唑类含能化合物的合成研究进展[J].
有机化学, 2013, 34(2): 304-315. ZHAO Ting-xing, LI Lei, DONG Zhan, et al. Research progress on the synthesis of energetic nitroazoles[J]. Chinese Journal of Organic Chemistry, 2013, 34(2): 304-315. |
| [4] |
郭俊玲, 曹端林, 王建龙, 等. 硝基吡唑类化合物的合成研究进展[J].
含能材料, 2014, 22(6): 872-879. GUO Jun-ling, CAO Duan-lin, WANG Jian-long, et al. Review on synthesis of nitropyrazoles[J]. Chinese Journal of Energetic Materials(Hanneng Cailiao), 2014, 22(6): 872-879. DOI:10.11943/j.issn.1006-9941.2014.06.031 |
| [5] |
Herve G, Roussel C, Graindorge H. Selective preparation of 3, 4, 5-trinitro-1H-pyrazole:a stable all-carbon-nitrated arene[J].
Angewandte Chem Int Ed, 2010, 122(18): 3245-3249. DOI:10.1002/ange.v122:18 |
| [6] |
Gao H, Shreeve J M. Azole-based energetic salts[J].
Chemical Reviews, 2011, 111(11): 7377-7436. DOI:10.1021/cr200039c |
| [7] |
Ek S, Latypov N, Herve G, et al.Synthesis of di-and trinitropyrazoles[C]//12th Seminar on New Trends in Research of Energetic Materials.Pardubice, April 1-3, Pardubice:Czech Republic, 2009:494.
|
| [8] |
覃光明, 葛忠学.
含能化合物合成反应与过程[M]. 北京: 化学工业出版社, 2011: 10-12.
QIN Guang-ming, GE Zhong-xue. Synthesis reactions and processes of energetic compound[M]. Beijing: Chemical Industry Press, 2011: 10-12. |
| [9] |
Dalinger I L, Vatsadze I A, Shkineva T K, et al. The specific reactivity of 3, 4, 5-trinitro-1H-pyrazole[J].
Mendeleev Communications, 2010, 20(5): 253-254. DOI:10.1016/j.mencom.2010.09.003 |
| [10] |
Ravi P, Tewari S P. Facile and environmentally friendly synthesis of nitropyrazoles using montmorillonite K-10 impregnated with bismuth nitrate[J].
Catalysis Communications, 2012, 19: 37-41. DOI:10.1016/j.catcom.2011.12.016 |
| [11] |
Ravi P, Gore G M, Tewari S P, et al. A simple and environmentally benign nitration of pyrazoles by impregnated bismuth nitrate[J].
Journal of Heterocyclic Chemistry, 2013, 50(6): 1322-1327. DOI:10.1002/jhet.v50.6 |
| [12] |
吕春绪.
硝酰阳离子理论[M]. 北京: 兵器工业出版社, 2006: 16-38.
LV Chun-xu. Nitroxyl cation theory[M]. Beijing: Weapon Industry Press, 2006: 16-38. |
| [13] |
Herve G.Dinitropyrazole derivatives, their preparation, and energetic compositions comprising them:US, 2009/0186931[P].2009.
|
| [14] |
Ek S, Latypov N V. Four Syntheses of 4-amino-3, 5-dinitropyrazole[J].
Journal of Heterocyclic Chemistry, 2014, 51(6): 1621-1627. DOI:10.1002/jhet.v51.6 |
| [15] |
Dalinger I L, Popova G P, Vatsadze I A, et al. Synthesis of 3, 4, 5-trinitropyrazole[J].
Russian Chemical Bulletin, 2009, 58(10): 2185-2185. DOI:10.1007/s11172-009-0301-2 |
| [16] |
Zhang Yan-qiang, Guo Yong, Joo Y H, et al. 3, 4, 5-trinitropyrazole-based energetic salts[J].
Chemistry-a European Journal, 2010, 16(35): 10778-10784. DOI:10.1002/chem.201001243 |
| [17] |
Zhao X, Zhang J C, Li S H, et al. A green and facile approach for synthesis of nitro heteroaromatics in water[J].
Organic Process Research & Development, 2014, 18(7): 886-890. |
| [18] |
孙昌俊, 曹晓冉, 王秀菊.
药物合成反应—理论与实践[M]. 北京: 化学工业出版社, 2007: 300-301.
SUN Chang-jun, CAO Xiao-ran, WANG Xiu-ju. Drug synthetic reactions:theory and practice[M]. Beijing: Chemical Industry Press, 2007: 300-301. |
| [19] |
Smith M B, March J.
March's advanced organic chemistry:reactions, mechanisms, and structure[M]. John Wiley & Sons, 2007.
|
| [20] |
Ravi P, Koti Reddy C K, Saikia A, et al. Nitrodeiodination of polyiodopyrazoles[J].
Propellants, Explosives, Pyrotechnics, 2012, 37(2): 167-171. DOI:10.1002/prep.v37.2 |
| [21] |
罗军, 蔡春, 吕春绪. 微波有机合成化学最新进展[J].
合成化学, 2002, 10(1): 17-24. LUO Jun, CAI Cun, LV Chun-xu. Recent development of microwave-induced organic reaction chemistry[J]. Chinese Journal o f Synthetic Chemistry, 2002, 10(1): 17-24. |
| [22] |
Ravi P, Tewari S P. Solvent free microwave assisted isomerization of N-nitropyrazoles[J].
Propellants, Explosives, Pyrotechnics, 2013, 38(1): 147-151. DOI:10.1002/prep.v38.1 |
| [23] |
Dalinger I L, Cherkasova T I, Popova G P, et al. Nitropyrazoles 14.Synthesis of 1, 3, 4-trinitropyrazole and its behavior in the nucleophilic substitution reactions.General method of synthesis of 5-substituted 3, 4-dinitropyrazoles[J].
Russian Chemical Bulletin, 2009, 58(2): 410-413. DOI:10.1007/s11172-010-0024-4 |
| [24] |
吕春绪. N2O5绿色硝化研究及其新进展[J].
含能材料, 2010, 18(6): 611-617. LV Chun-xu. Clean nitrating agent dinitrogen pentoxide and its application in nitration[J]. Chinese Journal of Energetic Materials(Hanneng Cailiao), 2010, 18(6): 611-617. |
| [25] |
王军, 景梅, 张晓玉, 等. 硝基二唑炸药爆炸参数的经验计算(Ⅱ)[J].
含能材料, 2013, 21(5): 609-611. WANG Jun, JING Mei, ZHANG Xiao-yu, et al. Empirical calculation of the explosive prameters of nitrodiazole explosives(Ⅱ)[J]. .Chinese Journal of Energetic Materials(Hanneng Cailiao), 2013, 21(5): 609-611. |
| [26] |
Dalinger I L, Vatsadze I A, Shkineva T K, et al. Synthesis and comparison of the reactivity of 3, 4, 5-1H-Trinitropyrazole and Its N-methyl derivative[J].
Journal of Heterocyclic Chemistry, 2013, 50(4): 911-924. DOI:10.1002/jhet.v50.4 |
| [27] |
Ravi P, Tewari S P. Faujasite catalyzed nitrodeiodination of iodopyrazoles[J].
Catalysis Communications, 2013, 42: 35-39. DOI:10.1016/j.catcom.2013.07.032 |
| [28] |
Ravi P, Gore G M, Sikder A K, et al. Silica-sulfuric acid catalyzed nitrodeiodination of iodopyrazoles[J].
Synthetic Communications, 2012, 42(23): 3463-3471. DOI:10.1080/00397911.2011.584261 |
| [29] |
郭俊玲, 李永祥, 王建龙, 等. 1-甲基-3, 4, 5-三硝基吡唑的一步法合成及热性能[J].
含能材料, 2015, 23(3): 304-306. GUO Jun-ling, LI Yong-xiang, WANG Jian-long, et al. One-step synthesis and thermal behavior of 1-methy-3, 4, 5-trinitropyrazole[J]. Chinese Journal of Energetic Materials(Hanneng Cailiao), 2015, 23(3): 304-306. DOI:10.11943/j.issn.1006-9941.2015.03.019 |
| [30] |
李雅津, 曹端林, 李永祥, 等. 1-甲基-3, 4, 5-三硝基吡唑的合成与表征[J].
火炸药学报, 2013, 36(3): 28-30. LI Ya-jin, CAO Duan-lin, LI Yong-xiang, et al. Synthesis and Characterization of 1-methy-3, 4, 5-trinitropyrazole[J]. Chinese Journal of Explosives & Propellants, 2013, 36(3): 28-30. |
| [31] |
Ravi P, Gore G M, Tewari S P, et al. Quantum chemical studies on the structure and performance properties of 1, 3, 4, 5-tetranitropyrazole:a stable new high energy density molecule[J].
Propellants, Explosives, Pyrotechnics, 2012, 37(1): 52-58. DOI:10.1002/prep.v37.1 |
| [32] |
欧育湘.
炸药学[M]. 北京: 北京理工大学出版社, 2006: 222-243.
OU Yu-xiang. Explosive[M]. Beijing: Beijing University of Science & Technology Press, 2006: 222-243. |
| [33] |
Drukenmuller I E, Klapotke T M, Morgenstern Y, et al. Metal salts of dinitro-, trinitropyrazole, and trinitroimidazole[J].
Zeitschrift fur anorganische und allgemeine Chemie, 2014, 640(11): 2139-2148. DOI:10.1002/zaac.201400233 |
| [34] |
潘功配. 烟火药的创新与发展[J].
含能材料, 2011, 19(5): 483-490. PAN Gong-pei. Innovation and development of pyrotechnic composition[J]. Chinese Journal of Energetic Materials (Hanneng Cailiao), 2011, 19(5): 483-490. |
| [35] |
黄海丰, 孟子晖, 周智明, 等. 含能盐和含能离子液体[J].
化学进展, 2009, 21(1): 152-163. HUANG Hai-feng, MENG Zi-hui, ZHOU Zhi-ming, et al. Energetic salts and energetic ionic liquids[J]. Progress in Chemistry, 2009, 21(1): 152-163. |
| [36] |
田均均, 张庆华, 李金山. 含能分子合成最新进展[J].
含能材料, 2016, 24(1): 1-9. TIAN Jun-jun, ZHANG Qing-hua, LI Jin-shan. Recent advances in energetic molecule synthesis[J]. Chinese Journal of Energetic Materials(Hanneng Cailiao), 2016, 24(1): 1-9. DOI:10.11943/j.issn.1006-9941.2016.01.001 |
| [37] |
李娜, 柴春鹏, 甘志勇, 等. 含能离子化合物的分子设计与性能研究进展[J].
含能材料, 2010, 18(4): 467-475. LI Na, CHAI Chun-peng, GAN Zhi-yong, et al. Review on molecular design and performance of energetic ionic compounds[J]. Chinese Journal of Energetic Materials(Hanneng Cailiao), 2010, 18(4): 467-475. |
| [38] |
Klapötke T M, Sabate C M. Bistetrazoles:nitrogen-rich, high-performing, insensitive energetic compounds[J].
Chemistry of Materials, 2008, 20(11): 3629-3637. DOI:10.1021/cm703657k |
| [39] |
Yin P, Parrish D A, Shreeve J M. Energetic multifunctionalized nitraminopyrazoles and their ionic derivatives:ternary hydrogen-bond induced high energy density materials[J].
Journal of the American Chemical Society, 2015, 137(14): 4778-4786. DOI:10.1021/jacs.5b00714 |
| [40] |
Yin P, Zhang J, Parrish D A, et al. Energetic fused triazoles-a promising C—N fused heterocyclic cation[J].
Journal of Materials Chemistry A, 2015, 3(16): 8606-8612. DOI:10.1039/C5TA01329A |

Synthesis methods, properties and applications of 3, 4, 5-trinitro-1 H pyrazole(TNP), and its covalent derivatives, and energetic ionic salts (including metal salts and nonmetal salts) were reviewed.The molecular design of energetic compounds of TNP as skeletonwas discussed.