2. 潍坊市食品药品检验检测中心, 山东 潍坊 262500
2. Weifang Food and Drag Inspection and Testing Center Institute, Weifang 262511, China
以苦味酸(PA)、斯蒂酚酸(TNR)和三硝基均苯三酚(TNPG)为主的多硝基多酚及其配合物, 因其热感度和火焰感度高, 易发火, 并且输出具有很高能量火焰的特点, 已被广泛应用于点火药的设计和生产[1-3]。但其作为含能材料在生产、储存等环节中, 硝基酚类物质会大量流失到土壤和地面沉积物中, 且在自然环境条件下, 硝基酚类物质的生物降解速率缓慢, 导致硝基酚在环境中长期滞留和积累, 对环境造成了严重污染。因此, 多硝基酚类对环境和人类健康造成的危害备受关注。
面对严重的污染现状, 国内外对于多硝基酚类物质的环境控制研究集中在污染的处理、控制技术[4-7], 在污染检测方面却相对滞后, 且在对污染治理的效果监测上采用多硝基酚类的总量进行检测, 无法对污染物进行定性、定量分析[8]。目前, 检测其他硝基酚类的方法主要有分光光度法[9]、气相色谱法[10]、液相色谱法[11, 12]、气相质谱-色谱联用法[13], 这些相关的方法都只涉及部分硝基酚类, 对于多硝基酚类特殊的强极性、热不稳定的化学性质所适合的检测方法研究较少。
因此定性、定量检测这些多硝基酚化合物对于解决环境污染以及生产控制等问题具有重要意义。本研究对PA、TNR和TNPG等14种硝基酚类物质进行结构和性质的研究, 对液相色谱柱经过大量筛选, 寻找到合适的全氟苯基柱, 采用超高效液相色谱法, 通过对色谱条件的优化, 将最初应用于农药残留检测的快速、简单、高效的QuEChERS(快速(Quick)、简单(Easy)、价廉(Cheap)、高效(Effective)耐用(Rugged)和安全(Safe))样品前处理方法[14-15], 代替较为繁琐的固相提取(SPE) [16-19]、加速溶剂提取(ASE)[20-22]、微波辅助提取(MAE)[23-25]和超声波辅助提取(USE)[26-28]等前处理方法, 建立了一种简单、快速的14种硝基酚类化合物同时测定的定性、定量分析方法, 为多硝基酚类含能材料及其分解产物的检测提供了技术支持。
2 实验部分 2.1 试剂与仪器AcquityTM超高效液相色谱仪(UPLC), 配二极管阵列检测器(Waters公司); AllegraTM X-22R型离心机(Beckman公司); Sk8200LH超声波清洗器(上海科导公司); Milli-QA10超纯水机; IKAMS3漩涡混合器; 0.45 μm过滤膜(Waters公司)。
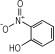
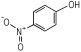
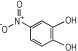
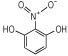
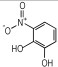
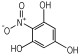
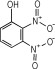
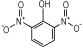
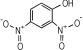
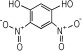
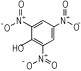
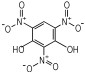
14种硝基酚类标准品分别为2-硝基苯酚(1)、4-硝基苯酚(2)、1, 2-二羟基-4-硝基苯(3)、2-硝基间苯二酚(4)、3-硝基-1, 2-苯二酚(5)、2-硝基间苯三酚(6)、2, 3-二硝基苯酚(7)、2, 5-二硝基苯酚(8)、2, 6-二硝基苯酚(9)、2, 4-二硝基苯酚(10)、4, 6-二硝基间苯二酚(11)、2, 4, 6-三硝基苯酚(12)、2, 4, 6-三硝基间苯二酚(13)、2, 4, 6-三硝基间苯三酚(14)(纯度>98%, 德国Dr. Ehrenstorfer GH公司), 具体见表 1。吸附剂填料N-丙基乙二胺(PSA)、石墨化碳黑(GCB)、C18(Agela公司)、乙腈(色谱纯, 德国Merck公司), 甲酸、乙酸铵(分析纯), 实验用水为超纯水。
| 表 1 14种硝基酚类物质的结构 Tab.1 Structure of fourteen nitrophenol compounds |
用乙腈将标准品配制成浓度为100 mg·L-1的单标标准储备液, 再将单标标准储备液稀释配制成混标储备液, 实验时以初始流动相将混合标准储备液配制成不同浓度的标准工作液。
2.3 QuEChERS一步提取净化前处理方法准确称取1.00 g土壤样品, 置于15 mL塑料离心管中, 加入1 mL水浸润20 min, 加入4 mL乙腈, 涡旋提取2 min, 离心后, 取上清液, 加入QuEChERS吸附剂, 涡旋2 min, 以10000 r·min-1高速离心3 min, 取上清液过0.45 μm膜上机检测。
2.4 超高效液相色谱分析条件分析色谱柱: Accucore PFP 2.1 mm×150 mm i.d., 2.6 μm, 柱温20 ℃; 进样体积5 μL; 流速0.3 mL·min-1。流动相为A:NH4Ac(10 mol·L-1)+甲酸(0.1%), 流动相B:乙腈; 采用梯度洗脱: 0~16 min, B 25% ~50%; 16 ~22 min, B 50% ~60%; 22 ~23 min, B 60% ~25%; 23% ~25min, B25%。
3 结果与讨论 3.1 色谱条件的选择14种硝基酚类的同时快速分离需要综合考虑化合物的性质和结构, 色谱分离条件的优化主要是从色谱柱、检测波长、流动相的选择、pH值和梯度洗脱方案等方面进行。
3.1.1 液相色谱柱的选择选择合适的色谱柱是液相分析方法的关键。液相色谱柱因其不同的色谱填料, 不同的键合技术使色谱柱的选择性也会有很大的差别。本研究优先选择实验室最常使用的色谱柱: C18, C8, HILIC, T3, pheny1色谱柱。首先比较14种目标物在以上5种色谱柱种的分离效果, 结果显示三硝基酚类物质在以上5种色谱柱上均保留太强, 甲醇、乙腈等流动相很难将其洗脱下来, 因此, 以上色谱柱不适合用于多硝基多酚类物质的检出。
为选择合适的色谱柱, 对色谱柱填料和被测物的结构、相互吸附性质进行研究, 选择对苯基化合物有特异性选择的全氟苯基色谱柱。结果显示, 该色谱柱对14种目标物显示了卓越的分离能力, 在优化的色谱条件下, 14种目标物可获得完全的基线分离。
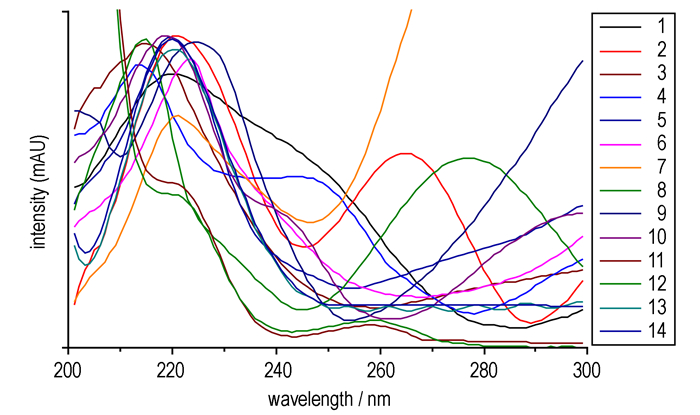
3.1.2 检测波长的选择检测波长的选择采用二极管阵列检测器, 在200~300 nm范围内对所有分析物进行紫外波长扫描, 14种硝基酚类物质的紫外吸收光谱图见图 1。结果显示, 14种化合物在220 nm附近的紫外吸收较高, 同时4-硝基苯酚、2, 3-二硝基苯酚、2, 5-二硝基苯酚、2, 6-二硝基苯酚在270~280 nm也有较大吸收, 但为同时保证14种目标化合物的同时检出, 且检出限尽可能小, 灵敏度尽可能高, 因此综合考虑各组分的最大吸收波长, 选择220 nm为检测波长。
|
图 1 14种硝基酚类物质的紫外吸收光谱 Fig.1 Ultraviolet absorption spectra of fourteen nitrophenol compounds |
流动相组成选择主要是缓冲盐体系和有机相, 缓冲盐体系主要有磷酸盐体系和乙酸盐体系。分别采用乙腈+水、磷酸缓冲盐、乙酸铵缓冲盐体系进行梯度洗脱, 对14种硝基酚类进行分离, 结果表明, 乙酸铵缓冲体系和的分离效果最好, 一方面乙腈的洗脱能力强, 各组分的分析时间明显缩短, 色谱峰对称; 另一方面, 选择乙酸铵体系, 不但有利于分离, 而且冲洗色谱柱方便。
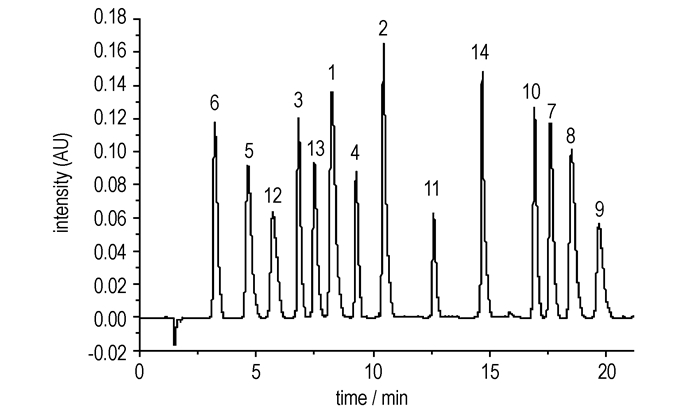
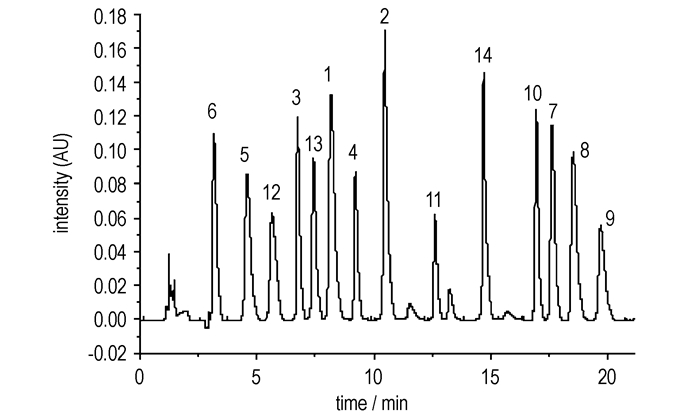
3.1.4 不同pH值对分离的影响用甲酸调节流动相pH值为2~6, 实验发现14种硝基酚类随着流动相的pH值降低可以改善峰形, 加强硝基酚类物质的保留。这主要是由于酚类等组分在中性条件下这些组分以阴离子的形式存在, 与固定相之间的相互作用较弱。随着pH值的降低, 这些组分以中性分子形式存在的比例越来越大, 在色谱柱上的保留也越来越强, 所以流动相的pH值对这些化合物在色谱柱上的保留行为影响较大; 综上所述, 最终选择流动相中添加0.1%的甲酸, 以加强目标物的更好地保留。采用梯度洗脱技术, 选择优化的最佳色谱条件, 将14种硝基酚混合标准样品在最短时间内实现了有效分离, 分离度好, 峰形对称尖锐, 无明显拖尾。14种硝基酚标准品液相色谱图见图 2。
|
图 2 14种硝基酚类物质标准品的液相色谱图 Fig.2 Liquid chromatogram of fourteen nitrophenol compound standard samples |
土壤等环境样品经QuEChERS提取、吸附剂净化, 取上清液过膜待测。方法简便、操作误差小, 适合同时测定多残留物的日常检验。
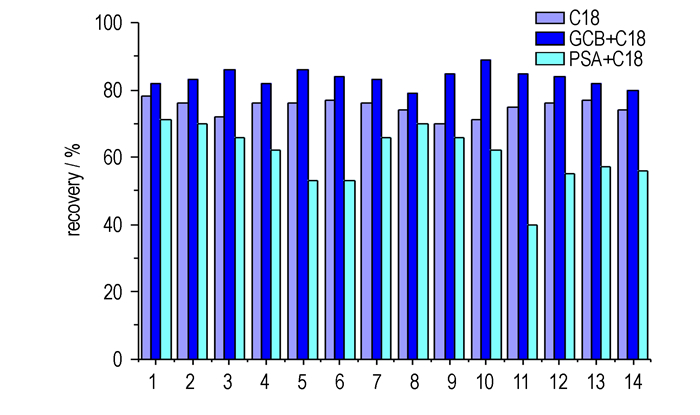
吸附剂对回收率的影响既因为吸附剂对分析物的吸附作用, 又与吸附剂对杂质的吸附净化效果可能导致的基质效应有关, 以致影响分析物在超高效液相色谱中的响应值。吸附剂的选择取决于样品提取物中的脂肪、蛋白、色素等大分子有机物或者杂质等的含量。土壤样品中存在脂肪、动植物残留、色素等杂质, 为选择合适的吸附剂, 比较了C18、GCB+C18、PSA+C18不同的吸附剂净化的样品回收率, 回收结果见图 3。由图 3可见, GCB+C18吸附剂的回收率最高, 说明该吸附剂对分析物吸附作用较小; 且由图 4可知, 经GCB+C18吸附剂填料处理的空白土壤加标样品色谱图和标准品色谱图对比, 可以看到处理后的土壤基质仅有少许杂峰, 对目标物的分离度和峰形均无影响, 说明该组合吸附剂同时对脂肪、蛋白和植物片状结构色素等杂质的净化效果较好, 因此选择GCB+C18作为吸附剂。
|
图 3 不同吸附剂填料对14种硝基酚类物质的回收率的影响 Fig.3 Effect of different sorbent on the recovery of fourteen nitrophenol compounds |
|
图 4 土壤基质中14种硝基酚类物质的的液相色谱 Fig.4 Liquid chromatogram of fourteen nitrophenolic compounds in soil |
同时由土壤基质添加标准品色谱图 4看出, 前处理方法净化后基质效应较小, 可以使用标准溶液直接定量, 方法更简便。
3.3 方法的线性关系与检出限在优化的实验条件下, 以配制0.2~50mg·L-1系列混合标准工作液。以各组分峰面积(Y)对浓度(X, mg·L-1)绘制标准曲线。表 2结果表明, 14种硝基酚类在各自的线性范围内具有良好的线性关系, 相关系数为0.9985~0.9995, 可以满足定量分析的要求。按3倍信噪比(S/N)计算土壤中14种硝基酚的检出限(LOD)为0.04~0.06 mg·kg -1。
| 表 2 在土壤空白基质中14种硝基酚类物质的线性方程、相关系数、检出限 Tab.2 Linear equations, correlation coefficients, LOD of fourteen nitrophenol compounds in blank substrate soil |
在0.2, 1.0, 10 mg·kg-1水平下进行加标回收实验, 每个水平重复测定5次, 14种硝基酚的平均回收率为81.3%~105.7%;相对标准偏差为3.6%~5.9%;均符合痕量残留检测的要求(表 3)。
| 表 3 在土壤空白基质中14种硝基酚类物质的添加回收率、精密度 Tab.3 Recoveries and RSD of fourteen nitrophenol compounds in blank substrate of soil |
| 表 4 不同区域土壤的检测结果 Tab.4 Detection of fourteen nitrophenol residues in different areas of the soil |
为了验证方法的实用性, 选择采集几个土壤样品, 包括农田、化学工业区、某合成区域附近三个不同地区, 采用本方法进行检测分析, 结果见表 5。被测的农田未检出目标化合物, 而化学工业区土壤样品检出有少量4-硝基苯酚、2, 4-二硝基苯酚, 某合成区域附近土壤检出含有一定浓度的2, 4, 6-三硝基间苯二酚。
4 结论首次采用改进的一步QuEChERS前处理方法, 实现了对强极性、难分离、热不稳定的三硝基苯酚、三硝基间苯二酚和三硝基均苯三酚等14种硝基酚类化合物在同一液相色谱条件下的分离、测定。该方法考察了前处理不同吸附剂的净化效果, 简化了前处理的步骤, 获得到了较高的回收率和较好的净化效果。液相方法选择全氟苯基色谱柱, 以乙腈和NH4Ac(10 mol·L-1)+甲酸(0.1%)作为流动相, 梯度洗脱, 检测波长为220 nm, 在优化的QuEChERS前处理和液相色谱分离分析条件下, 14种硝基酚类化合物在22 min内实现完全基线分离, 检出限为0.02~0.04 mg·L-1回收率为81.3%~105.7%, 相对标准偏差3.6%~5.9%。由实际环境样品的检测结果可知, 本方法具有简便快捷、灵敏、准确等特点, 能够满足土壤、地面沉积物等环境样品中痕量硝基酚类污染物检测的要求, 可用于含能材料多硝基酚类化合物及其分解物定性和定量的快速分析。
| [1] |
张同来, 武碧栋, 杨利, 等. 含能配合物研究新进展[J].
含能材料, 2013, 2013, 21(2): 137-151. ZHANG Tong-lai, WU Bi-dong, YANG Li, et al. Recent research progresses in energetic coordination compounds[J]. Chinese Journal of Energetic Materials(Hanneng Cailiao), 2013, 2013, 21(2): 137-151. |
| [2] |
Wu Bi-dong, TANG Shi-min. The environmentally friendly energetic salt (ATZ)(TNPG)based on 4-a-mino-1, 2, 4-triazole(ATZ) and trinitrophloroglucinol (TNPG)[J].
Zeitschrift für Anorganische und Allgemeine Chemie, 2012, 638(14): 2347-2352. |
| [3] |
唐时敏. 三硝基均苯三酚系列化合物研究(Ⅱ)[D]. 北京: 北京理工大学, 2012.
TANG Shi-min. Researches on a series of trinitrophloroglucinol compounds(Ⅱ)[D]. Beijing: Beijing Institute of Technology.2012 |
| [4] |
Singh B, Kaur J, Singh K. 2, 4, 6-Trinitrophenol degradation by Bacillus cereus isolated from a firing range[J].
Biotechnol Lett, 2011, 33(12): 2411-2415. DOI:10.1007/s10529-011-0726-1 |
| [5] |
Shen J, Zhang J, Zuo Y, et al. Biodegradation of 2, 4, 6-trinitrophenol by rhodococcus sp. isolated from a picric acid-contaminated soil[J].
J Hazard Mater, 2009, 163(23): 1199-1206. |
| [6] |
Weidhaas J L, Schroeder E D, Chang D P. An aerobic sequencing batch reactor for 2, 4, 6-trinitrophenol (picric acid) biodegradation[J].
Biotechnol Bioeng, 2007, 97(6): 08-1414. |
| [7] |
Yost S L, Pennington J C, Brannon J M, et al. Environmental process descriptors for TNT, TNT-related compounds and picric acid in marine sediment slurries[J].
Institute of Microbiology, 2007, 54(8): 1262-1266. |
| [8] |
Khue N, Chat N V, Minh do B, et al. Degradation and mineralization of 2, 4, 6-trinitroresorcine in various photochemical systems[J].
Mater Sci Eng C Mater Biol Appl, 2013, 33(4): 1975-1982. DOI:10.1016/j.msec.2013.01.008 |
| [9] |
Niazi A, Yazdanipour A. Spectrophotometric simultaneous determination of nitrophenol isomers by orthogonal signal correction and partial least squares[J].
Talanta, 2009, 146(1-2): 421-427. |
| [10] |
Wang J. Simultaneous determination of nitrophenol isomers by gas chromatography with dimethyl phthalate as internal standard[J].
Chinese Journal of Chromatography, 2004, 22(5): 562 |
| [11] |
Burdel M, Šandrejová J, Balogh I S, et al. A comparison of various modes of liquid-liquid based microextraction techniques: determination of picric acid[J].
Chem Commun (Camb), 2012, 48(41): 5007-5009. DOI:10.1039/c2cc31606d |
| [12] |
Li S, Li T, Gao P, et al. Slow-injection ultrasound assisted emulsification microextraction for determination of phthalate esters in water[J].
J Chromatogr Sc, 2013, 405(21): 791-797. |
| [13] |
Hu C, Chen B, He M, et al. Amino modified multi-walled carbon nanotubes polydimethylsiloxane coated stir bar sorptive extraction coupled to high performance liquid chromatography-ultraviolet detection for the determination of phenols in environmental samples[J].
J Chromatogr A, 2013, 51(10): 165-172. |
| [14] |
Elbarbry F, Wilby K, Alcorn J. Validation of a HPLC method for the determination of p-nitrophenol hydroxylase activity in rat hepatic microsomes[J].
J Chromatogr. B Analyt Technol Biomed Life Sci, 2006, 834(2): 199-203. |
| [15] |
Pdilla-Sánchez JA, Plaza-Bola os P. Simultaneous analysis of chlorophenols, alkylphenols, nitrophenols and cresols in wastewater effluents, using solid phase extraction and further determination by gas chromatography-tandem mass spectrometry[J].
Talanta, 2011, 85(5): 2397-2404. DOI:10.1016/j.talanta.2011.07.081 |
| [16] |
Zhu S, Niu W, Li H, et al. 4-nitrophenol Single-walled carbon nanohorn as new solid-phase extraction adsorbent for determination of 4-nitrophenol in water sample[J].
Talanta, 2009, 79(5): 1441-1445. DOI:10.1016/j.talanta.2009.06.011 |
| [17] |
Allen D, Bui A D, Cain N, et al. Analysis of free and bound phenolics in wine and grapes by GC-MS after automated SPE[J].
Anal Bioanal Chem. Anal Bioanal Chem, 2013, 68(7): 132-134. |
| [18] |
Liu X, Yang T, Hu J. Determination of benazolin-ethyl residues in soil and rape seed by SPE clean-up and GC with electron capture detection[J].
J Chromatogr Sci, 2013, 51(1): 87-91. DOI:10.1093/chromsci/bms102 |
| [19] |
Gineys N, Giroud B, Vulliet E. Analytical method for the determination of trace levels of steroid hormones and corticosteroids in soil, based on PLE/SPE/LC-MS/MS[J].
Anal Bioanal Chem, 2010, 397(6): 2295-2302. DOI:10.1007/s00216-010-3787-4 |
| [20] |
Wu G, Dong S, Panll L, et al. Determination of eight defoliant residues in cotton by accelerated solvent extraction coupled with ultra performance liquid chromatography-tandem mass spectrometry[J].
Chinese Journal of Chromatography, 2013, 31(7): 697-702. DOI:10.3724/SP.J.1123.2012.12038 |
| [21] |
Ge X, Wu X, Liang S, et al. A Sensitive and Validated HPLC Method for the Determination of Cyromazine and Melamine in Herbal and Edible Plants Using Accelerated Solvent Extraction and Cleanup with SPE[J].
J Chromatogr Sci, 2013, 408(25): 452-756. |
| [22] |
XU Dun-ming, LU Sheng-yu, CHEN Da-jie, et al. Determination of ten pesticides of pyrazoles and pyrroles in tea by accelerated solvent extraction coupled with gas chromatography-tandem mass spectrometry[J].
Chinese Journal of Chromatography, 2013, 31(3): 418-222. |
| [23] |
Prakash Maran J, Sivakumar V, Sridhar R. Optimization of microwave assisted extraction of pectin from orange peel[J].
Carbohydr Polym, 2013, 97(2): 703-709. DOI:10.1016/j.carbpol.2013.05.052 |
| [24] |
Al Bittar S, Périno-Issartier S, Dangles O, et al. An innovative grape juice enriched in polyphenols by microwave-assisted extraction[J].
Food Chem, 2013, 141(3): 3268-3272. DOI:10.1016/j.foodchem.2013.05.134 |
| [25] |
Samavati V. Central composite rotatable design for investigation of microwave-assisted extraction of okra pod hydrocolloid[J].
Int J Biol Macromo, 2013, 61(3): 142-149. |
| [26] |
Moreno-González D, Huertas-Pérez J F, García CamPa a A M, et al. Ultrasound-assisted surfactant enhanced emulsification microextraction for the determination of carbamates in wines by ultra-high performance liquid chromatography-tandem mass spectrometry[J].
J Chromatogr A, 2013, 5(9): 1315-1317. |
| [27] |
Luzardo O P, Ruiz-Suárez N, Almeida-González M, et al. Multi-residue method for the determination of 57 Persistent Organic Pollutants in human milk[J].
Anal Bioanal Chem, 2013, 41(10): 341-343. |
| [28] |
Lega F, Contiero L, Biancotto G, et al. determination of chemical drugs added illegally in Chinese patent[J].
Food Addit Contam Part A Chem Anal Control Expo Risk Assess, 2013, 30(6): 949-957. DOI:10.1080/19440049.2013.780212 |
With an ultra performance liquid chromatography (UPLC), the simultaneous determination was established for fourteen nitrophenol compounds in soil and ground sediment of production areas of energetic materials.