偏二甲肼((CH3)2NNH2, UDMH)是目前被广泛应用的液体推进剂。偏二甲肼属于高毒物质, 易通过吸入、接触和误食等引起中毒。长期接触低浓度偏二甲肼, 会出现注意力不集中、记忆力减退、食欲不振、肝功能异常等症状[1-2]。在偏二甲肼的生产使用过程中会产生大量的废水, 偏二甲肼废水为难降解有毒废水, 废水成分复杂, 主要污染物有二甲胺、偏腙、亚硝基二甲胺、二甲基二氮烯、四甲基四氮烯、乙醛二甲基腙等十几种组分, 其中亚硝基二甲胺是强致癌物质[3-4]。
偏二甲肼废水的传统处理方法, 如活性炭吸附法、离子交换法、化学焚烧法、臭氧氧化法、氯化法等, 存在运行成本高、安全系数低等问题[5]。本课题组从驯化的活性污泥中分离筛选出偏二甲肼高效降解菌, 并以此构建了偏二甲肼高效降解菌群(FYD), 利用FYD处理偏二甲肼废水, 取得了理想效果[6]。
为深入了解微生物复杂的代谢本质, 本研究用Haldane生长抑制动力学模型模拟菌群FYD的生长动力学过程, 用Andrews非竞争性底物抑制动力学模型模拟偏二甲肼的降解动力学过程, 拟合出动力学方程, 通过对模型的分析得出微生物新陈代谢与偏二甲肼浓度的变化关系, 对于偏二甲肼废水的生物处理具有指导意义。
2 模型建立 2.1 模型建立原则微生物降解动力学行为表现为以下几个方面:一是细胞生长消耗, 用以合成新的细胞; 二是细胞维持基本生命活动的基质消耗; 三是用于合成代谢产物的基质消耗[7]。故降解动力学模型一般由三部分组成: (1)生长模型; (2)产物生成模型; (3)基质消耗模型。按建模方式将动力学分为三类: (1)机制模型; (2)数学拟合模型; (3)正规模型。微生物反应过程非常复杂, 建立机制模型几乎不可能。而数学拟合模型建模较为简便, 便于分析验证, 易实现计算机自动化, 因此应用最为广泛。通过建模可更深刻了解微生物复杂的代谢本质, 寻找最合适的操作条件, 实现降解过程的最优化控制。
2.2 菌群FYD生长动力学模型建立研究表明由于偏二甲肼的毒性, 复合菌群FYD的停滞期随着偏二甲肼浓度的升高而延长。累计降解率随偏二甲肼初始浓度的升高, 先上升后下降[6]。从出水水质的检测结果可以看出, 亚硝基二甲胺等有害降解产物浓度很低, 因此设定偏二甲肼为菌群生长单一限制基质, 并假设在反应过程中培养基中的溶解氧是充足的, 并为一常数。因此本研究应用Haldane生长抑制动力学模型来模拟菌群FYD的生长动力学过程[8-9]:
| $\mu = \frac{{{\mu _{\max }}S}}{{S + {K_{{\rm{s\mu }}}} + \frac{{{S^2}}}{{{K_{{\rm{i\mu }}}}}}}}$ | (1) |
式中, μ为细菌比生长速率, h-1; S为偏二甲肼的初始浓度, mg·L-1; μmax为最大比降解速率, h-1; Ksμ、Kiμ分别为底物半饱和常数和底物抑制常数, mg·L-1。
2.3 偏二甲肼降解动力学模型建立在复合菌群FYD降解偏二甲肼过程中, 一部分偏二甲肼用于新细胞的增殖, 另一部分则转化为降解产物, 并产生维持细胞各项正常生理功能和生命活动所需能量[10]。对于一定量的偏二甲肼, 转化为新细胞的比例是一定的, 因此, 偏二甲肼降解速率和菌群增长速率之间有如下关系:
| $\frac{{{\rm{d}}X}}{{{\rm{d}}t}} = {y_0}\frac{{{\rm{d}}S}}{{{\rm{d}}t}}$ | (2) |
式中, X为细菌质量浓度,%; y0为产率系数, 表示降解单位质量偏二甲肼所产生的菌群细菌数量。因此
| $\mu = \frac{1}{X}\frac{{{\rm{d}}X}}{{{\rm{d}}t}} = - {y_0}\frac{1}{X}\frac{{{\rm{d}}S}}{{{\rm{d}}t}}$ | (3) |
令
| $\mu = {y_0}q$ | (4) |
结合式(1), 复合菌群降解偏二甲肼的动力学可用Andrews方程描述[11-12]:
| $q = \frac{{{q_{\max }}S}}{{S + {K_{{\rm{sq}}}} + \frac{{{S^2}}}{{{K_{{\rm{iq}}}}}}}}$ | (5) |
式中, q为偏二甲肼比降解速率, h-1; S为偏二甲肼的初始浓度, mg·L-1; qmax为最大比降解速率, h-1; Ksq、Kiq分别为底物饱和常数和底物抑制常数, mg·L-1。
3 模型的求解 3.1 菌群生长曲线 3.1.1 菌群生长曲线的测定将菌群接种到肉汤培养基中, 35 ℃、140 r·min-1振荡培养。每2 h取样测定菌液在600 nm处的吸光度(OD600), 绘制菌群生长曲线,如图 1所示。
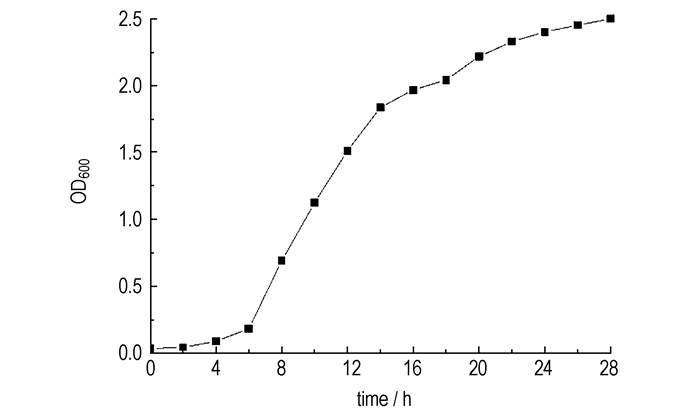
|
图 1 菌群FYD生长曲线 Fig.1 Growth curve of flora FYD |
细胞的质量采用恒重干燥法测定, 具体方法:将耐高温的离心管放置于60 ℃恒温干燥箱中干燥至恒重, 并记录。取一定体积不同生理时期菌液, 离心, 倾去上清液。用无菌水冲洗细胞, 反复洗涤三次, 弃上清液, 然后将离心管和菌体放置于60 ℃恒温干燥箱中干燥12 h, 称量至恒重, 称量记录[13]。
通过统计分析, OD600和细胞干重(X)呈线性关系(如图 2所示)。拟合方程式为:
| $X = 0.725 \times {\rm{O}}{{\rm{D}}_{600}} + 0.007$ | (6) |
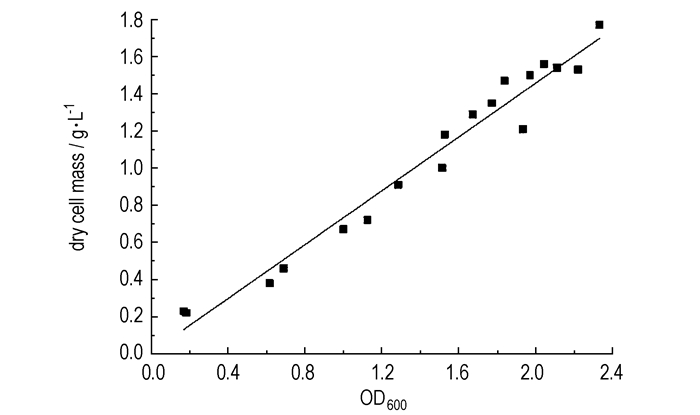
|
图 2 OD600与细胞干重相关性 Fig.2 The correlation between OD600 and dry cell mass |
R2=0.965, 拟合方程线性良好。
3.2 生长动力学模拟方程求解将复合菌群FYD种子液适度稀释, 使OD600=1.0±0.1, 分别接种到装有上述不同偏二甲肼初始浓度(30、50、80、100、120 mg·L-1)的培养基中, 35 ℃振荡培养, 4 h取样一次, 分别测量OD600和残余偏二甲肼浓度。
细菌在单一底物中的生长可用(7)式和(8)式表示:
| $\mu = \frac{1}{X}\frac{{{\rm{d}}X}}{{{\rm{d}}t}}$ | (7) |
在对数生长期时,
| $\mu = \frac{{{\rm{d}}\ln X}}{{{\rm{d}}t}}$ | (8) |
根据偏二甲肼初始浓度从30 mg·L-1到120 mg·L-1, 在对数期的菌体浓度, 可以由一阶模型动力学方程((9)式)表示:
| $\ln X = \mu t + \ln {X_0}$ | (9) |
式中, X0为停滞期时的菌体质量, mg·L-1; t为对数生长期的时间, h。
实验中对每一偏二甲肼初始浓度S0, 由式(9)计算出其比生长速率μ, 结果见表 1。
| 表 1 不同偏二甲肼初始浓度中的生长动力学模拟方程 Tab.1 Simulated equations of growth kinetics in different initial concentration of UDMH |
实验中偏二甲肼是唯一抑制性底物, 经过短暂的停滞期后, 复合菌群呈线性生长(R2>0.981)。将在不同的偏二甲肼初始浓度中获得的实验数据拟合的比生长速率μ, 用来估计菌体生长的动力学参数。
比生长速率与偏二甲肼初始浓度的关系见图 3。从图 3中可以看出, 比生长速率的实验值随着偏二甲肼初始浓度的升高先升高后降低。偏二甲肼初始浓度为50 mg·L-1时, 比生长速率达到最大值0.168 h-1。偏二甲肼初始浓度大于80 mg·L-1时, 比生长速率迅速下降。研究结果表明在偏二甲肼浓度高于80 mg·L-1时, 底物对菌体的生长抑制作用明显。从图 3可以看出, Haldane模型和实验值拟合较好, 这说明回归曲线和实验数据吻合良好。
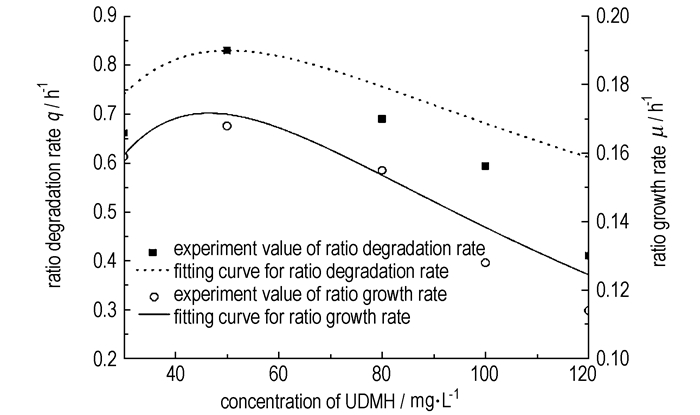
|
图 3 菌群FYD生长动力学与UDMH降解动力学拟合曲线 Fig.3 The fitting curves for growth kinetics of flora FYD and degradation kinetics of UDMH |
通过Matlab软件处理实验数据μ-S, 按照方程(1)对实验数值进行非线性最小二乘曲线拟合及其函数lsqcurvefit的调用, 可得μmax=0.8041 h-1, Ksμ=85.6768 mg·L-1和Kiμ=22.2874 mg·L-1(Resnorm=8.4775×10-5)。因此, 复合菌群FYD在偏二甲肼废水中的生长动力学方程为:
| $\mu = \frac{{0.8041S}}{{85.6768 + S + \frac{{{S^2}}}{{22.2874}}}}$ | (10) |
对应偏二甲肼初始浓度S0, 比降解速率q由式(11)拟合得到。
| $q = - \frac{1}{{{X_t}}}\frac{{{\rm{d}}S}}{{{\rm{d}}t}}$ | (11) |
因为偏二甲肼存在挥发和自然氧化, 式中dS=(St+Skt)-S0, Skt为t时刻空白中偏二甲肼的减少量。但不同底物浓度对于菌体生长的影响仍用S0代表。
比降解速率与偏二甲肼初始浓度的关系见图 3。当偏二甲肼初始浓度低于50 mg·L-1时, 实验值q随偏二甲肼初始浓度的升高迅速增大。当偏二甲肼初始浓度高于80 mg·L-1时, 偏二甲肼的抑制作用开始变得明显。在高浓度下, 偏二甲肼表现出来的抑制作用确实存在。按照Andrews方程对实验数值进行非线性最小二乘曲线拟合及其函数lsqcurvefit的调用, 可得qmax=7.2646 h-1, Ksq=194.5688 mg·L-1和Kiq=12.9654 mg·L-1(Resnorm=0.0689)。
因此, 复合菌群FYD降解偏二甲肼的动力学方程为:
| $q = \frac{{7.2646S}}{{194.5688 + S + \frac{{{S^2}}}{{12.9654}}}}$ | (12) |
由图 3可见, 实验数据与模型拟合良好。qmax为偏二甲肼废水的生物处理工艺化提供了重要的参考条件。
比较图 3中比生长速率μ和比降解速率q的拟合曲线, 可以看出比生长速率μ和比降解速率q的变化趋势相似。比生长速率μ和比降解速率q出现最大值时偏二甲肼初始浓度都在50 mg·L-1附近, 与实验数据相符。以μ对q作图, 拟合得到一直线, 如图 4所示。
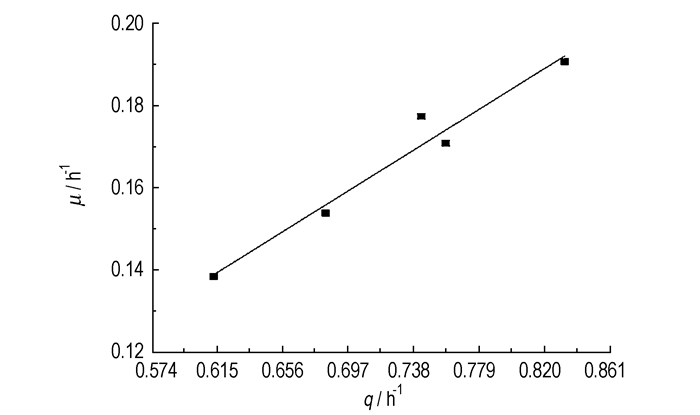
|
图 4 比生长速率与比降解速率相关性 Fig.4 Correlation between the ratio growth rate and the ratio degradation rate |
拟合直线方程为: μ=0.229q, R2=0.957。结合式(4), 菌群FYD降解偏二甲肼的产率系数为0.229。最大比生长速率与最大降解速率的线性关系表明在菌群FYD降解偏二甲肼过程中存在物料平衡, 细胞生长随着偏二甲肼浓度的变化存在合理性, 在不同的偏二甲肼浓度中qmax和μmax存在一种积极的关系。实验结果也同时证明了偏二甲肼的降解动力学可用Andrews方程来描述。
4 模型的讨论在以上三个动力学常数中, 抑制常数Ki表明抑制底物的抑制灵敏度。Ks为半饱和常数, 定义为当比生长速率为最大生长速率的一半时底物的浓度, 也是比降解速率为最大降解速率的一半时底物的浓度。当Ks越小时, 即底物的浓度越低时, 比生长速率越接近于最大生长速率的一半, 或比降解速率越接近于最大降解速率的一半。Ks的值还可表明微生物对底物的亲和力。然而, 如果底物对微生物的生长有抑制作用时, 很难监测到实际的μmax和qmax。因此Ks只是一个理论值[12]。对方程(1)作变换, 得到式(13):
| $\mu = \frac{{{\mu _{\max }}}}{{1 + \frac{{{K_{{\rm{s\mu }}}}}}{S} + \frac{S}{{{K_{{\rm{i\mu }}}}}}}}$ | (13) |
| $\mu \le \frac{{{\mu _{\max }}}}{{1 + 2\sqrt {\frac{{{K_{{\rm{s\mu }}}}}}{S}\frac{S}{{{K_{{\rm{i\mu }}}}}}} }}$ | (14) |
当
在偏二甲肼初始浓度低于43.6980 mg·L-1时, 比生长速率的理论值随着偏二甲肼浓度的升高而迅速升高, 当偏二甲肼初始浓度高于43.6980 mg·L-1时, 比生长速率的理论值开始逐渐下降。在偏二甲肼初始浓度低于50.2261 mg·L-1时, 比降解速率的理论值随着偏二甲肼浓度的升高而迅速升高, 当偏二甲肼初始浓度高于50.2261 mg·L-1时, 比降解速率的理论值开始下降。计算结果表明, 偏二甲肼初始浓度为43.6980 mg·L-1时, 菌群有最大比生长速率; 偏二甲肼初始浓度为50.2261 mg·L-1时, 偏二甲肼有最大比降解速率, 理论值非常接近于实验值的偏二甲肼浓度50 mg·L-1, 模型很好地反映了菌群FYD降解偏二甲肼的实际情况。
5 结论(1) 用Haldane生长抑制动力学模型模拟菌群FYD的生长动力学过程, 用Andrews非竞争性底物抑制动力学模型模拟偏二甲肼的降解动力学过程, 通过Matlab软件处理实验数据μ-S, 拟合动力学方程分别为:
| $\mu = \frac{{0.8041S}}{{85.6768 + S + \frac{{{S^2}}}{{22.2874}}}},q = \frac{{7.2646S}}{{194.5688 + S + \frac{{{S^2}}}{{12.9654}}}}$ |
回归结果表明,模型可以较好地描述菌体生长和底物降解的过程。
(2) 通过方程计算, 当偏二甲肼初始浓度为43.6980 mg·L-1时, 菌群有最大比生长速率, 偏二甲肼初始浓度为50.2261 mg·L-1时, 偏二甲肼有最大比降解速率, 理论值非常接近于实验值50 mg·L-1, 模型很好地反映了菌群FYD降解偏二甲肼的实际情况。
(3) 菌群FYD降解偏二甲肼的产率系数为0.229, 反映了菌群FYD对偏二甲肼的耐受性和利用情况。比生长速率与降解速率的线性关系表明在菌群FYD降解偏二甲肼过程中存在物料平衡, 细胞生长随着偏二甲肼浓度的变化存在合理性, 在不同的偏二甲肼浓度中qmax和μmax存在一种积极的关系。
| [1] |
王煊军, 刘祥萱, 杨蓉.
液体推进剂分析[M]. 西安: 第二炮兵工程学院, 2002.
WANG Xuan-jun, LIU Xiang-xuan, YANG Rong. Liquid propellant analysis[M]. Xi'an: The Second Artillery Engineering College, 2002 |
| [2] |
范春华, 王力, 谢珊珊. 驯化活性污泥对偏二甲肼的降解动力学[C]//酒泉: 中国化学会第六届全国化学推进剂学术会议, 2013: 607-611.
FAN Chun-hua, WANG Li, XIE Shan-shan. Degradation kinetics of activated sludge degradation of UDMH[C]//The Proceedings of the Six National Rocket Propellant Application Technology Conference, 2013: 607-611. |
| [3] |
Fedorov L A. Liquid missile propellants in the former soviet union[J].
Environmental Pollution, 1999, 105(2): 157-161. DOI:10.1016/S0269-7491(98)00224-3 |
| [4] |
樊秉安, 任向红.
液体推进剂污染控制与资源回收利用[M]. 北京: 中国环境科学出版社, 2001.
FAN Bing-an, REN Xiang-hong. Liquid propellant recycling[M]. Beijing: China environmental science press, 2001 |
| [5] |
夏本立, 范春华, 王煊军, 等. 一种应对偏二甲肼泄露到水体中的生物降解技术[J].
含能材料, 2012(6): 794-798. XIA Ben-li, FAN Chun-hua, WANG Xun-jun, et al. A biodegradation method towards UDMH leaking into water[J]. Chinese Journal of Energetic Materials(Hanneng Cailiao), 2012(6): 794-798. |
| [6] |
范春华, 夏本立, 王煊军, 等. 降解偏二甲肼污水高效菌群的构建[J].
化学推进剂与高分子材料, 2012(1): 82-85. FAN Chun-hua, XIA Ben-li, WANG Xun-jun, et al. Construction of high efficient bacteria flora for degrading UDMH wastewater[J]. Chemical Propellants & Polymeric Materials, 2012(1): 82-85. |
| [7] |
Jiang Y, Wen J P, Bai J, et al. Biodegradation of phenol at high initial concentration by Alcaligenes faecalis[J].
J Hazard Mater, 2007, 147: 672-676. DOI:10.1016/j.jhazmat.2007.05.031 |
| [8] |
Arutchelvan V, Kanakasabai V, Elangovan R, et al. Kinetics of high strength phenol degradation using Bacillus brevis[J].
J Hazard Mater, 2006, 129: 216-222. DOI:10.1016/j.jhazmat.2005.08.040 |
| [9] |
杨柳燕, 肖琳.
环境微生物技术[M]. 北京: 科学出版社, 1984.
YANG Liu-yan, XIAO Lin. Environmental Engineering Microbiology[M]. Beijing: Science Press, 1984 |
| [10] |
Mayer J G, Gallegos J R, Ordaz N R, et al. Phenol and 4-chloroPhenol biodegradation by yeast Candida tropicalis in a fluidize bed reactor[J].
Biochemical Engineering Journal, 2008(38): 147-157. |
| [11] |
王静, 王竞, 周集体. 固定化混合菌好氧生物降解硝基苯的特性及动力学研究[J].
上海环境科学, 2008, 27(5): 296-200. WANG Jing, WANG Jing, ZHOU Ji-ti. A study on characteristics and kinetics of aerobic biodegradation of Nitrokenzene by immobilized cells of a defineed mocrobial consortium[J]. Shanghai Environmental Science Press, 2008, 27(5): 296-200. |
| [12] |
Lesllie Grady C P, Daigger G T, Lim H C. Biological wastewater treatment[M]. USA: New York, Marcel Dekker Inc. 1999.
|
| [13] |
周群英, 高廷耀.
环境工程微生物学[M]. 北京: 高等教育出版社, 2000.
ZHOU Qun-ying, GAO Ting-yao. Environmental Microbiology[M]. Beijing: High Eduication Press, 2000 |

The growth kinetic process of efficient bacteria flora (FYD) for degrading unsymmetrical dimethyl hydrazine (UDMH) was simulated by Haldane kinetic model of growth inhibition. The degradation kinetic process of UDMH was simulated by Andrews noncompetitive kinetic model of substrate inhibition.



