金刚烷及其衍生物是有机笼状化合物中一类重要的化合物, 可以广泛应用于药物、含能材料、功能高分子等领域。其中多硝基金刚烷由于其分子结构的高度对称性, 具有高能、低感等优点, 可用于炸药、推进剂、烟火剂和燃料等领域中, 故其理论和实验研究受到人们的高度重视[1-4]。多硝基金刚烷的能量及爆轰性能随着其所含硝基数目的增加而提高[5-6]。
近三十年来, 多硝基金刚烷的合成取得了一定的进展。早在1980年, Sollott和Gilbert等就以金刚烷为原料, 成功合成了金刚烷叔碳上四取代的1, 3, 5, 7-四硝基金刚烷(TNA) [7]。随后在1988年, Archibald等成功合成了2, 2-二硝基金刚烷及2, 2, 6, 6-四硝基金刚烷, 并指出金刚烷骨架上偕二硝基的引入能大大提高化合物的密度[8]。1990年, Dave合成出了2, 2, 4, 4-四硝基金刚烷[9]。1995年, Axenrod等成功制得了1, 2, 2-三硝基金刚烷, 该化合物结构中既含单硝基又含偕硝基, 但由于空间位阻效应较大, 其稳定性较差[10]。1993年, Dave提出了2, 2, 4, 4, 6, 6-六硝基金刚烷(HNA)的合成, 该化合物以4-亚甲基金刚烷-2, 6-二酮为起始原料, 经过4, 4-二硝基金刚烷-2, 6-二酮, 然后再进行肟化和硝化, 最终制得目标产物, 总收率为0.24%[11-13]。其中酮肟的偕硝化反应采用硝酸作为硝化剂, 收率较低。计算结果表明HNA的爆速约为8700 m·s-1, 爆压约为34.6 GPa, 是一种性能优越的高能炸药。
本研究改进了Dave的合成工艺, 优化了Meerwein′s酯的合成及环外双键的臭氧化反应。重点研究了以绿色硝化剂N2O5进行的偕硝化反应, 考察了不同硝化体系、N2O5用量、反应时间、反应温度和溶剂对反应收率的影响, 确定了最佳反应条件。另外, 采用1H NMR、13C NMR、IR及元素分析表征了中间体和HNA的结构; 培养了HNA单晶, 并进行了晶体结构研究; 初步研究了HNA的热力学性质, 为该化合物的进一步研究提供参考。
2 实验部分 2.1 合成路线合成路线见Scheme 1。

|
Scheme 1 |
Nicolet傅里叶变换红外光谱仪(美国Thermofisher公司); Bruker Avance-Ⅲ DRX 500MHz核磁共振仪(德国Bruker公司); Vario EL-Ⅲ型元素分析仪(德国Elemetar公司); WRS-1B数字熔点仪(上海申光仪器仪表有限公司); SDT Q600 DSC-TGA同步热分析仪(美国TA仪器公司); Nonius CAD4 X射线四圆衍射仪(荷兰Enraf Nonius公司)。
五氧化二氮采用硝酸经五氧化二磷脱水法自制[14], 其它试剂均为分析纯。
2.3 合成实验 2.3.1 Meerwein′s酯(2)的合成将228 mL (1.50 mol)丙二酸二乙酯、37.5 g(1.25 mol)多聚甲醛、4.2 mL(0.038 mol)N-甲基哌嗪和200 mL甲苯依次加入1 L圆底烧瓶中, 室温搅拌2 h, 然后100 ℃反应8 h, 最后120 ℃反应10 h。减压蒸馏得浅黄色油状液体, 冷却至室温, 待用。
将57.4 g(1.06 mol)甲醇钠加入400 mL无水甲醇中, 剧烈搅拌下向其中加入上述浅黄色油状液体。65 ℃回流12 h, 析出浅黄色固体, 冷却至室温后, 在冰浴条件下继续反应2 h, 向体系中加入200 mL乙醚, 继续冰浴30 min。抽滤, 滤饼用乙醚与甲醇的混合溶剂(V:V=1:4)洗涤, 得白色固体。将白色固体溶于500 mL水中, 用6 mol·L-1盐酸调节pH至4~5, 析出大量白色固体, 抽滤, 收集滤饼, 真空干燥, 得101 g(0.26 mol)白色固体2, 收率70%, m.p.153.5~153.9 ℃(文献值[15]: m.p.163~164 ℃)。1H NMR (CDCl3, 500 MHz) δ: 12.18 (s, 2H), 3.80~3.77 (d, J=6.25 Hz, 12H), 2.90~2.86 (d, J=4.85 Hz, 4H), 2.34 (s, 2H); 13C NMR (CDCl3, 125 MHz) δ: 172.49, 171.93, 168.18, 96.91, 52.76, 51.94, 47.70, 35.30, 29.71; FT-IR (ν/cm-1): 2952, 1442, 1365 (C—H), 1737, 1652 (—C=O), 1232 (—C—O); Anal. calcd for C17H20O10: C 53.13, H 5.25; found: C 53.07, H 5.32。
2.3.2 双环[3.3.1]壬烷-2, 6-二酮(3)的合成将101 g(0.26 mol)化合物2溶于240 mL冰醋酸中, 并向体系中缓慢滴加165 mL 6 mol·L-1盐酸, 回流反应12 h, 减压蒸馏得浅黄色固体, 固体用100 mL二氯甲烷溶解, 用饱和碳酸氢钠水溶液洗涤, 收集有机相, 水相继续用二氯甲烷(2×50 mL)萃取, 合并有机相, 用无水硫酸钠干燥, 过滤, 减压蒸馏, 真空干燥, 得31.2 g (0.21 mol)浅黄色固体3, 收率78%, m.p.139.4~140.5 ℃(文献值[16]: m.p.138~140 ℃)。1H NMR (CDCl3, 500 MHz) δ: 2.71 (d, J=1.7 Hz, 2H), 2.61~2.52 (m, 2H), 2.43~2.32 (m, 2H), 2.18 (s, 2H), 2.12~1.98 (m, 4H); 13C NMR (CDCl3, 125 MHz) δ: 212.70, 43.55, 37.11, 31.42, 26.66; FT-IR (ν/cm-1): 2935, 1439 (C—H), 1694 (—C=O); Anal. calcd for C9H12O2: C 71.03, H 7.95; found: C 71.15, H 7.86。
2.3.3 4-亚甲基金刚烷-2, 6-二酮(4)的合成将9.15 g(60.12 mmol)化合物3加入到144 mL乙酸酐中, 搅拌至完全溶解, 向反应瓶中缓慢滴加1.5 mL浓硫酸, 120 ℃反应3 h, 补加144 mL乙酸酐, 继续反应5 h。减压蒸馏得褐色固体, 固体用100 mL二氯甲烷溶解, 用饱和碳酸氢钠水溶液洗涤, 收集有机相, 水相继续用二氯甲烷(2×100 mL)萃取, 合并有机相, 用无水硫酸钠干燥, 过滤, 减压蒸馏得棕色黏稠状液体, 硅胶柱层析, 石油醚/乙酸乙酯(V:V=4:1)洗脱, 得4.03 g(22.85 mmol)白色固体4, 收率38%, m.p.159.8~161.3 ℃(文献值[17]: m.p.160~162 ℃)。1H NMR (CDCl3, 500 MHz) δ: 4.83 (s, 2H), 3.32 (m, 2H), 2.76 (m, 2H), 2.37~2.28 (m, 4H), 2.25~2.21 (m, 2H); 13C NMR (CDCl3, 125 MHz) δ: 209.98, 147.39, 109.30, 56.37, 44.76, 39.86, 39.32; FT-IR(ν /cm-1): 3060, 903 (C=C—H), 2945, 1457 (C—H), 1707 (—C=O), 1650 (C=C); Anal. calcd for C11H12O2: C 74.98, H 6.86; found: C 75.12, H 6.78。
2.3.4 2, 2, 6, 6-二乙撑二氧基-4-亚甲基金刚烷(5)的合成将8.05 g(45.68 mmol)化合物4、0.78 g (4.56 mmol)对甲苯磺酸、10 mL (180 mmol)乙二醇和150 mL甲苯依次加入250 mL圆底烧瓶中, 130 ℃反应3 h。减压蒸馏得淡黄色固体, 固体用100 mL二氯甲烷溶解, 用饱和食盐水洗涤三次, 收集有机相, 用无水硫酸钠干燥, 过滤, 减压蒸馏, 粗产品用二氯甲烷/正己烷重结晶, 得11.35 g(42.94 mmol)白色颗粒状晶体5, 收率94%, m.p.118.9~119.7 ℃(文献值[11]: m.p.119~120 ℃)。1H NMR (CDCl3, 500 MHz) δ: 4.78 (s, 2H), 3.92~4.07 (m, 8H), 2.41 (s, 2H), 2.07~1.98 (m, 4H), 1.93~1.87 (m, 2H), 1.83~1.81 (m, 2H); 13C NMR (CDCl3, 125 MHz) δ: 150.51, 110.33, 106.97, 64.42, 46.40, 35.00, 32.25, 31.29; FT-IR(ν /cm-1): 3081, 904 (C=C—H), 2936, 1450 (C—H), 1659 (C=C), 1232 (C—O); Anal. calcd for C15H20O4: C 68.16, H 7.63; found: C 68.32, H 7.52。
2.3.5 2, 2, 6, 6-二乙撑二氧基-4-金刚烷酮(6)的合成将11.35 g (42.94 mmol)化合物5溶于175 mL乙酸乙酯中, 并向反应瓶中加入5 g分子筛, 缓慢通入臭氧, -37 ℃下反应2 h。放置至室温, 向其中滴加硫代硫酸钠水溶液, 室温搅拌1 h。静置分层, 取上层有机相, 水相继续用乙酸乙酯萃取两次, 合并有机相, 用无水硫酸钠干燥, 过滤, 减压蒸馏除去溶剂, 残余物硅胶柱层析, 石油醚/乙酸乙酯(V:V=4:1)洗脱, 得5.83 g(21.90 mmol)白色固体6, 收率51%, m.p.164.2~166.0 ℃(文献值[11]: m.p.164~166 ℃)。1H NMR(CDCl3, 500 MHz) δ: 4.05~3.91 (m, 8H), 2.67 (m, 2H), 2.15~2.05 (m, 4H), 2.05~1.95 (m, 2H), 1.91~1.88 (m, 2H); 13C NMR (CDCl3, 125 MHz) δ: 209.32, 111.09, 64.83, 64.61, 54.64, 35.14, 30.86, 29.44; FT-IR(ν /cm-1): 2941, 1452 (C—H), 1723 (—C=O), 1232 (C—O); Anal. calcd for C14H18O5: C 63.15, H 6.81; found: C 62.95, H 7.08。
2.3.6 2, 2, 6, 6-二乙撑二氧基-4-金刚烷酮肟(7)的合成将5.83 g(21.90 mmol)化合物6加入150 mL乙醇中, 搅拌至固体完全溶解, 依次加入3.04 g(43.8 mmol)盐酸羟胺, 3.59 g(43.8 mmol)无水乙酸钠, 室温反应10 h。减压蒸馏, 固体用80 mL二氯甲烷溶解, 用饱和碳酸氢钠水溶液洗涤, 收集有机相, 水相继续用二氯甲烷(2×50 mL)萃取, 合并有机相, 用无水硫酸钠干燥, 过滤, 减压蒸馏, 粗产品用二氯甲烷/正己烷重结晶, 得5.85 g(20.81 mmol)白色颗粒状晶体7, 收率95%, m.p.221.2~223.0 ℃(文献值[11]:m.p.219~221 ℃)。1H NMR (DMSO-d6, 500 MHz) δ: 10.1 (s, 1H), 3.8~4.0 (m, 8H), 3.40 (m, 1H), 2.33 (m, 1H), 1.6~2.0 (m, 8H); 13C NMR (CDCl3, 125 MHz) δ: 161.22, 110.23, 110.06, 64.72, 64.59, 64.55, 43.73, 36.55, 35.60, 35.42, 31.07, 31.00, 29.86; FT-IR(ν /cm-1): 3249 (NO—H), 2937, 1451(C—H), 1645(C=N), 1236(C—O), 912(N—O); Anal. calcd for C14H19NO5: C 59.78, H 6.81, N 4.98; found: C 59.62, H 7.06, N 4.82。
2.3.7 2, 2, 6, 6-二乙撑二氧基-4, 4-二硝基金刚烷(8)的合成将5.85 g(20.81 mmol)化合物7溶于175 mL二氯甲烷中, 向体系中加入2.85 g(47.43 mmol)尿素和5 g分子筛, 加热至回流(50 ℃)。N2保护下, 向体系中缓慢滴加五氧化二氮的二氯甲烷溶液(6.75 g N2O5, 20 mL CH2Cl2), 反应30 min。将反应混合液倒入200 mL的冰水混合物中, 静置分层, 取下层有机相, 水相继续用二氯甲烷(2×100 mL)萃取, 合并有机相, 用无水硫酸钠干燥, 过滤, 减压蒸馏得淡黄色固体, 硅胶柱层析, 石油醚/乙酸乙酯(V:V=32:1)洗脱, 得4.63 g(13.53 mmol)白色固体8, 收率65%。回收1.12 g(4.21 mmol)化合物6, 将化合物6继续肟化, 偕硝化, 得0.78 g(2.28 mmol)化合物8。两次总共得到5.41 g (15.81mmol)产物, 总收率76%, m.p.235.4~236.5 ℃。1H NMR (CDCl3, 500 MHz) δ: 3.84 (m, 2H), 2.75~2.68 (m, 2H), 2.54~2.31 (m, 4H), 2.05~1.95 (m, 2H); 13C NMR (CDCl3, 125 MHz) δ: 121.55, 108.90, 64.75, 64.40, 40.32, 34.69, 30.93, 27.87; FT-IR(ν /cm-1): 2945, 1460 (C—H), 1568, 1371 (—NO2), 1238 (C—O), 946 (N—O), 843 (C—N); Anal. calcd for C14H18N2O8: C 49.12, H 5.30, N 8.18; found: C 49.23, H 5.18, N 8.34。
2.3.8 4, 4-二硝基金刚烷-2, 6-二酮(9)的合成将5.41 g(15.81 mmol)化合物8溶于200 mL二氯甲烷中, 然后冰浴条件下向体系中缓慢滴加51.2 mL浓硫酸, 室温反应2 h。将反应混合液倒入200 mL冰水混合物中, 静置分层, 取下层有机相, 水相继续用二氯甲烷(2×100 mL)萃取, 合并有机相, 用无水硫酸钠干燥, 减压蒸馏, 粗产品用丙酮/正己烷重结晶, 得3.82 g(15.02 mmol)白色颗粒状晶体9, 收率95%, m.p.246.5~248.0 ℃(文献值[11]: m.p.244~246 ℃)。1H NMR (DMSO-d6, 500 MHz) δ: 3.84 (s, 2H), 2.71 (s, 2H), 2.51~2.35 (m, 4H), 2.03~1.99 (m, 2H); 13C NMR (DMSO-d6, 125 MHz) δ: 203.70, 123.87, 51.03, 43.34, 41.81, 32.89; FT-IR(ν /cm-1): 2932, 1463 (C—H), 1738 (—C=O), 1558, 1371 (—NO2), 952 (N—O), 848 (C—N); Anal. calcd for C10H10N2O6: C 47.25, H 3.97, N 11.02; found: C 47.36, H 4.12, N 10.83。
2.3.9 4, 4-二硝基金刚烷-2, 6-二酮肟(10)的合成将3.82 g(15.02 mmol)化合物9溶于150 mL甲醇中, 依次加入6.26 g(90.12 mmol)盐酸羟胺和7.39 g(90.12 mmol)乙酸钠, 回流反应12 h。减压蒸馏, 固体用100 mL二氯甲烷溶解, 用饱和碳酸氢钠水溶液洗涤, 取有机相, 水相继续用二氯甲烷(2×50 mL)萃取, 合并有机相, 用无水硫酸钠干燥, 过滤, 减压蒸馏, 粗产品用二氯甲烷/正己烷重结晶, 得3.93 g(13.83 mmol)白色颗粒状晶体10, 收率92%, m.p.207.8~210.5 ℃(文献值[11]: m.p.208~210 ℃)。1H NMR (DMSO-d6, 500 MHz) δ: 11.21~11.15 (m, 2H), 4.81~4.73, 3.89~3.85 (m, 2H), 3.54, 2.68 (m, 2H), 2.19~2.15, 2.08~1.97 (m, 2H), 1.93~1.68 (m, 4H); 13C NMR (DMSO-d6, 125 MHz) δ: 155.15, 153.85, 122.20, 122.08, 42.62, 42.40, 41.12, 38.75, 36.39, 35.41, 35.07, 34.81, 34.47, 33.80, 33.68, 33.24, 32.90, 26.83, 26.70; FT-IR(ν/cm-1): 3285(NO—H), 2945, 1458(C—H), 1671(C=N), 1581, 1361(—NO2), 957 (N—O), 839 (C—N); Anal. calcd for C10H12N4O6: C 42.26, H 4.26, N 19.71; found: C 42.37, H 4.32, N 19.59。
2.3.10 2, 2, 4, 4, 6, 6-六硝基金刚烷(1)的合成将1.00 g(3.52 mmol)化合物10溶于45 mL二氯甲烷中, 向体系中加入0.63 g(10.56 mmol)尿素和2 g分子筛, 加热至回流(50 ℃)。在N2保护下, 向体系中缓慢滴加五氧化二氮的二氯甲烷溶液(2.28 g N2O5, 10 mL CH2Cl2), 反应30 min。将反应混合液倒入50 mL的冰水混合物中, 静置分层, 取下层有机相, 水相继续用二氯甲烷(2×50 mL)萃取, 合并有机相, 用无水硫酸钠干燥, 过滤, 减压蒸馏得淡黄色固体, 硅胶柱层析, 石油醚/乙酸乙酯(V:V=12:1)洗脱, 得0.50 g (1.23 mmol)白色固体1, 收率35%。同时得到0.46 g(1.40 mmol)四硝基金刚烷酮11和0.14 g (0.53 mmol)二硝基金刚烷酮9, 将化合物11继续肟化, 偕硝化, 得0.17 g(0.42 mmol)化合物1。两次总共得到0.67 g(1.65 mmol)白色固体1, 总收率47%, m.p.198.9~200.4 ℃(文献值[11]: m.p.198~200 ℃)。1H NMR (CDCl3, 500 MHz) δ: 4.82~4.77 (m, 2H), 3.40~3.10 (m, 4H), 2.76~2.68 (m, 2H), 2.07~2.03 (m, 2H); 13C NMR (CDCl3, 125 MHz) δ: 119.72, 119.42, 37.47, 32.67, 30.26, 29.77; FT-IR(ν /cm-1): 3010, 1474 (C—H), 1580, 1358 (—NO2), 935 (N—O), 839 (C—N); Anal. calcd for C10H10N6O12: C 29.57, H 2.48, N 20.69; found: C 29.43, H 2.56, N 20.48。
2.4 HNA单晶培养和晶体结构测定 2.4.1 单晶培养称取适量HNA, 用二氯甲烷/正己烷混合溶剂重结晶, 将晶体溶于氯仿中, 溶液过滤后静置进行单晶培养, 20 d后得到可用于晶体结构测定的无色单晶。
2.4.2 结构测定选取尺寸为0.30 mm×0.20 mm×0.10 mm的单晶, 在Nonius cad4四圆X射线衍射仪上, 采用石墨单色化的MoKα射线(λ=0.071073 nm)作为衍射源, 在293 K下以ω/2θ方式扫描, 在1.70°≤θ≤25.38°, 0≤h≤14, 0≤k≤25, -14≤ l ≤14的范围内共收集衍射点5859个, 其中独立衍射点5580个(收集5859个强反射数据, 其中5580个为独立衍射点(Rint=0.0413), 可观察衍射点2885个[I>2σ(I)])。晶体结构由直接法解出, 对全部非氢原子的坐标及各向异性参数用SHELXL-97程序以最小二乘法修正对F2进行精修, 最终偏离因子收敛于R=0.1534, wR=0.1915。
3 结果与讨论 3.1 Meerwein′s酯的合成文献中关于Meerwein′s酯的制备, 通常以丙二酸二甲酯和多聚甲醛为原料, 以哌啶为催化剂在苯中反应[15, 18-19]。本研究用丙二酸二乙酯代替丙二酸二甲酯, 并以毒性更小的甲苯作为反应溶剂来制备Meerwein′s酯, 考察了不同催化剂对反应收率的影响。
Meerwein′s酯的合成分两步进行, 第一步反应为Knoevenagel缩合反应。Knoevenagel缩合反应常用的碱性催化剂有哌啶、吡啶和其他一级胺、二级胺等。研究了哌啶、哌嗪、N-甲基哌嗪、吗啉、二乙胺、二乙醇胺等有机碱对反应的影响, 结果如表 1所示。研究表明, 链状的二乙胺作催化剂时, Meerwein′s酯的收率为34%。但用二乙醇胺作催化剂时效果很差, 虽然能检测到产物, 但却不能直接从体系中结晶分离出来。使用环状二级胺哌啶可以获得60%的收率。使用含两个二级胺单元的哌嗪作催化剂时收率有所下降。而用含氧原子的吗啉时效果却很差, 不能分离出产物。当用既含二级胺又含三级胺的N-甲基哌嗪作为反应催化剂时, 反应收率最高, 可达到70%。因此最终选择N-甲基哌嗪为反应催化剂。
| 表 1 催化剂对Meerwein′s酯收率的影响 Tab.1 Effect of catalysts on the yield of Meerwein′s ester |
文献报道的臭氧化反应以乙酸乙酯为溶剂, 在-78 ℃下向体系中通入臭氧进行氧化反应, 然后用甲硫醚还原反应过程中形成的臭氧化物, 最终得到目标产物, 收率为41%[11]。将臭氧化反应控制在-37 ℃下进行, 反应完成后以更价廉易得且处理方便的硫代硫酸钠代替甲硫醚作为还原剂, 以与文献相当的收率合成出氧化产物化合物6。考虑到水的存在对臭氧化反应的影响较大, 因此考察了向反应体系中加入适量分子筛的条件, 结果发现反应收率提高到51%, 也证实了溶剂中微量水的存在也可以对臭氧化反应产生明显影响。
3.3 基于N2O5绿色硝化剂的偕硝化反应以2, 2, 6, 6-二乙撑二氧基-4-金刚烷酮肟(7)为反应底物, 以N2O5为硝化剂, 分别研究了N2O5的用量、反应时间、反应温度和溶剂对反应收率的影响。其中, 第一步偕硝化收率提高到65%, 第二步偕硝化收率提高到35%。实验过程中还发现, 向反应体系中加入分子筛和尿素等添加剂时, 可有效地提高反应收率。
3.3.1 偕硝化反应体系的选择以0.2 g (0.7 mmol)化合物7为底物, 采用HNO3/CH2Cl2、N2O4/Et2O和N2O5/CH2Cl2三种硝化体系在回流条件下进行偕硝化反应, 反应结果列于表 2。由表 2可以看出, 以N2O5作为硝化试剂时, 偕硝化的收率远远比传统的HNO3/CH2Cl2和N2O4/Et2O高。可能的原因是, N2O5较另外的两种硝化剂在具有更强硝化活性的同时, 还在回流温度下易分解从而具有更强的氧化性, 可以将反应过程中形成的不稳定的亚硝基中间体快速氧化成硝基, 从而减少副反应的发生, 提高反应收率。
| 表 2 硝化剂对偕二硝基化合物收率的影响1) Tab.2 Effect of nitrating agents on the yield of gem-dinitro compound |
在50 ℃下, 以二氯甲烷为溶剂, 反应时间为30 min, 改变N2O5用量, 考察化合物7与N2O5物料配比对反应收率的影响, 具体结果见表 3。
| 表 3 N2O5的用量对偕二硝基化合物收率的影响1) Tab.3 Effect of N2O5 on the yield of gem-dinitro compound |
由表 3可以看出, 当N2O5和原料等当量时, 收率为36%。当N2O5用量为原料的三倍时, 收率达到最高值, 为65%。但是继续增大N2O5的用量, 收率反而降低。原因在于N2O5在偕硝化反应中既作硝化剂又作氧化剂, 因此至少需要两倍当量的N2O5才能将反应底物完全转化成偕二硝基产物。这种推测通过观察到至少加入两倍当量的N2O5反应体系中的绿色才会褪去得到证实。另外, 由于N2O5在回流条件下易分解失去活性, 因此需加入过量的N2O5以保证反应顺利进行。当N2O5的量继续增加时, 反应体系的酸性增强, 而偕硝基产物在酸性条件下易发生分解, 转化为相应的酮[8], 使反应收率降低。最终确定N2O5与原料的最佳摩尔比为3:1。
3.3.3 反应时间对偕硝化收率的影响在50 ℃下, 以二氯甲烷为溶剂, 物料配比n(7):n(N2O5)=1:3, 考察反应时间对收率的影响, 具体结果见表 4。
| 表 4 反应时间对偕二硝基化合物收率的影响1) Tab.4 Effect of reaction time on the yield of gem-dinitro compound |
由表 4可以看出, 反应时间对反应收率的影响较大。在反应15 min时, 偕二硝基产物收率为42%, 随着反应时间的延长收率也相应增加, 当反应时间为30 min时, 收率达到最大值, 为65%。继续延长反应时间, 收率开始下降。造成这种现象的原因可能是随着反应时间的延长, 偕硝基产物在酸性条件下发生分解, 转化为相应的酮。所以, 最终选定反应时间为30 min。
3.3.4 反应温度对偕硝化收率的影响以二氯甲烷为溶剂, 物料配比n(7):n(N2O5)=1:3, 反应时间为30 min, 考察反应温度对收率的影响, 具体结果见表 5。
| 表 5 反应温度对偕二硝基化合物收率的影响1) Tab.5 Effect of reaction temperature on the yield of gem-dinitro compound |
由表 5可以看出, 随着反应温度的增加, 反应收率先增大后减小。当反应温度为50 ℃时, 偕硝化反应的收率达到最高, 为65%。这是由于随着反应温度的升高, 偕硝化反应的活性提高, 反应收率也随着提高。但温度过高, 亚硝基中间体会发生偶合等副反应, 降低了反应的选择性, 且N2O5也会来不及反应就快速分解, 从而造成转化不完全。因此最终选择50 ℃为最佳反应温度。
3.3.5 溶剂对偕硝化收率的影响在50 ℃下, 物料配比n(7):n(N2O5)=1:3, 反应时间为30 min, 研究了氯仿、二氯甲烷、1, 2-二氯乙烷和硝基甲烷四种常用有机溶剂对偕硝化反应收率的影响, 发现氯代烃效果比硝基甲烷明显更好, 其中又以二氯甲烷作为溶剂时效果最佳, 反应收率最高, 可达到65%。
| 表 6 溶剂对偕二硝基化合物收率的影响1) Tab.6 Effect of solvents on the yield of gem-dinitro compound |
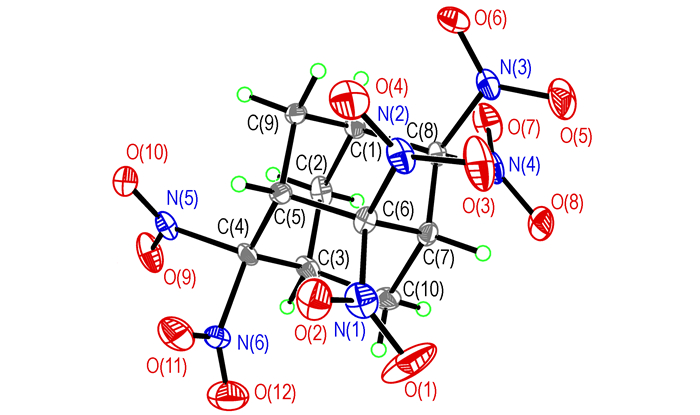
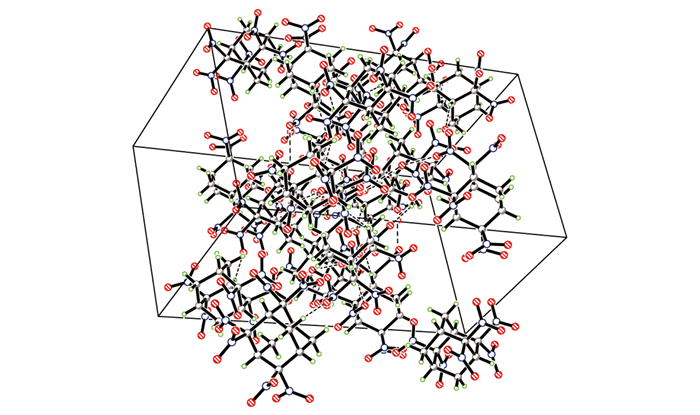
HNA的晶体结构和分子在晶胞中的堆积分别示于图 1和图 2。
|
图 1 HNA的分子立方体构型图 Fig.1 Molecular stereo configuration of HNA |
|
图 2 HNA的晶胞3D堆积图 Fig.2 3D Packing of HNA in crystal lattice |
晶体分子式为C10H10N6O12, 分子量: 406.24, 晶体分析结果表明, 该晶体为单斜晶系, 属P2(1)/n空间群, 晶体学参数为a=12.011(2) nm, b=21.129(4) nm, c=11.967(2) nm, α=90°, β=90.59(3)°, γ=90°; V=3.0368(131) nm3; Z=8; Dc=1.777 g·cm-3; μ=0.160; F(000)=1664。晶体结构数据存于英国剑桥数据中心, CCDC号为953576。
HNA的晶体结构中, 一个分子的C—H键与另一个分子的硝基之间存在弱的C—H…O作用。两分子的HNA通过弱的C—H…O作用, 以二聚体的形式存在, 氢键参数如表 7所示。HNA分子中金刚烷骨架的C—C键平均键长为1.525Å, C—C—C平均键角为109.5°, 与金刚烷的C—C键长(1.54Å)和C—C—C键角(109.5°)相似, 表明金刚烷骨架结构未发生明显的扭曲。而与2, 2-二硝基金刚烷和2, 2, 4, 4-四硝基金刚烷相似, HNA分子中与偕硝基相连的部分, 键长键角参数发生明显变化:金刚烷骨架与硝基相连的C—N键长为1.550Å和1.578Å, 比普通的C(sp3)—NO2键长(1.46~1.50Å)长, 而N—C—N键角则缩小到96°。这种键的延长可能是由于偕二硝基的存在, 使与N相邻的C原子上电荷密度降低, 对电子的束缚能力降低, C—N的稳定性降低, 从而导致键长变长, 而由于偕硝基与金刚烷骨架结构之间的空间位阻, 使硝基发生偏转, N—C—N键角变小。从HNA的晶体结构和晶胞堆积图可以看出, 由于偕硝基的存在和金刚烷骨架的刚性结构, 所造成的空隙空间较大, 因而使其晶胞堆积不紧密, 晶体密度较小, 仅为1.777 g·cm-3, 仅比2, 2, 6, 6-四硝基金刚烷的密度(1.75 g·cm-3)略高[8]。
| 表 7 氢键的几何结构 Tab.7 Hydrogen-bond geometry |
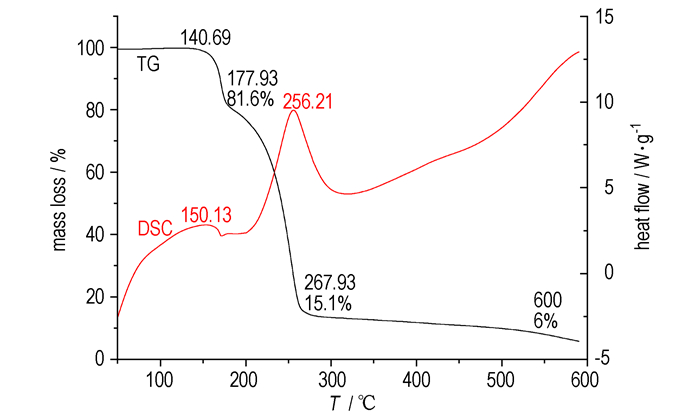
在N2流速为30.0 mL·min-1、升温速率为20.0 ℃·min-1、升温区间为50~600 ℃条件下测试了2, 2, 4, 4, 6, 6-六硝基金刚烷的TG-DSC曲线, 样品量为1.5 mg, 结果如图 3所示。
|
图 3 HNA的TG-DSC曲线(20 ℃·min-1) Fig.3 TG-DSC curves of HNA at 20 ℃·min-1 |
TG曲线表明, HNA的热分解分为三个阶段:第一阶段为140.69~177.93 ℃, 失重18.4%, 该过程中一组偕硝基发生分解, 生成相应的四硝基金刚烷酮; 第二阶段为177.93~267.93 ℃, 失重66.5%, 这个过程对应的是HNA分子结构的整体分解, 由于是负氧平衡, 因此会有单质碳生成; 第三阶段为267.93~600 ℃, 失重9.1%, 可能是包裹在碳中的一些有机物的继续分解, 也可能是单质碳与二氧化碳反应生成了一氧化碳。从开始分解到结束共失重94%。
HNA的DSC曲线上有两个放热峰, 分别为HNA两个分解阶段的分解放热峰。在256.21 ℃有一个明显的放热峰, 表示HNA在该温度发生了剧烈的放热分解反应。
4 结论(1) 以丙二酸二乙酯和多聚甲醛为原料, 经过环合、脱羧、缩酮化、臭氧化、肟化、偕硝化等步骤, 合成了2, 2, 4, 4, 6, 6-六硝基金刚烷(HNA), 反应总收率由文献的0.24%提高到3%。通过1H NMR、13C NMR、IR和元素分析对中间体及目标化合物的结构进行了表征。首次培养了HNA单晶, 并进行了晶体结构研究: HNA晶体属于单斜晶系, P2(1)/n空间群, 晶体密度为1.777 g·cm-3, 两分子的HNA通过弱的C—H…O作用, 以二聚体的形式存在。初步研究了HNA的热力学性质, HNA的热分解分为三个阶段, 从开始分解到结束共失重94%。HNA在256.21 ℃发生了剧烈的放热分解反应。
(2) 以丙二酸二乙酯替代丙二酸二甲酯, N-甲基哌嗪替代哌啶, 并以甲苯为溶剂, 以70%的收率合成出了Meerwein′s酯。环外双键的臭氧化反应中, 采用硫代硫酸钠作还原剂, 并向反应体系中加入分子筛, 使反应收率提高了10%。
(3) 酮肟的偕硝化反应, 应用五氧化二氮作硝化剂, 优化了偕硝化反应的工艺条件:物料配比n(7):n(N2O5)=1:3, 反应温度为50 ℃, 反应时间为30 min, 反应溶剂为二氯甲烷, 反应收率由文献中的37%[14]提高到65%。将该工艺条件用于化合物10的合成中, 也取得了较好的效果, 反应收率由文献中的21%[21]提高到35%。
| [1] |
许晓娟, 肖鹤鸣, 居学海, 等. 多硝基金刚烷红外光谱和热力学性质的理论研究[J].
含能材料, 2005, 13(1): 40-44. XU Xiao-juan, XIAO He-ming, JU xue-hai, et al. Theoretical study on the vibrational spectra, thermodynamic properties for polynitroadamantanes[J]. Chinese Journal of Energetic Materials(Hanneng Cailiao), 2005, 13(1): 40-44. |
| [2] |
王飞, 许晓娟, 肖鹤鸣, 等. 多硝基金刚烷生成热和稳定性的理论研究[J].
化学学报, 2003, 61(12): 1939-1943. WANG Fei, XU Xiao-juan, XIAO He-ming, et al. Theoretical studies on heat of formation and stability for polynitroadamantanes[J]. Acta Chimica Sinica, 2003, 61(12): 1939-1943. DOI:10.3321/j.issn:0567-7351.2003.12.010 |
| [3] |
Vishnevskii E N, Kuzmin V S, Golod E L. Nitration of adamantine by nitrogen dioxide[J].
Zhurnal Organicheskoi Khimii, 1996, 32(7): 1030-1390. |
| [4] |
Skare D, Suceska M. Polynitroadamantanes-new caged high-energetic molecules[J].
Chemistry in Industry, 1995, 44(12): 511-518. |
| [5] |
许晓娟, 肖鹤鸣, 贡雪东, 等. NO2气相硝化金刚烷的计算研究[J].
化学学报, 2006, 64(4): 306-312. XU Xiao-juan, XIAO He-ming, GONG Xue-dong, et al. Computational studies on the nitration of adamantane with NO2[J]. Acta Chimica Sinica, 2006, 64(4): 306-312. |
| [6] |
罗军, 李娅琼. 用改进的Sollott法合成1, 3, 5, 7-四硝基金刚烷[J].
火炸药学报, 2011, 34(5): 13-15. LUO Jun, LI Ya-Qiong. Synthesis of 1, 3, 5, 7-tetranitroadamantane via modified sollott′s route[J]. Chinese Journal of Explosives and Propellants, 2011, 34(5): 13-15. |
| [7] |
Sollott G P, Gilbert E E. A facile route to 1, 3, 5, 7-tetraaminoadamantane: synthesis of 1, 3, 5, 7-tetranitroadamantane[J].
The Journal Of Organic Chemistry, 1980, 45: 5405-5408. DOI:10.1021/jo01314a051 |
| [8] |
Archibald T G, Baum K. Synthesis of polynitroadamantanes: oxidations of oximinoadamantanes[J].
The Journal of Organic Chemistry, 1988, 53(20): 4646-4649. |
| [9] |
Dave P R, Ferraro M. Synthesis of 2, 2, 4, 4-tetranitroadamantane[J].
The Journal of Organic Chemistry, 1990, 55: 4459-4461. DOI:10.1021/jo00301a047 |
| [10] |
Theodore A, Lida Q. Synthesis of 1, 2, 2-trinitroadamantane[J].
The Journal of Organic Chemistry, 1995, 60: 1895-1896. DOI:10.1021/jo00111a062 |
| [11] |
Paritosh R D. The synthesis and complete 1H and 13C NMR spectral assignment of 2, 2, 4, 4, 6, 6-hexanitroadamantane and its precursor nitroketones by 2D NMR spectroscopy[J].
Tetrahedron, 1992, 48: 5839-5846. DOI:10.1016/S0040-4020(01)90175-9 |
| [12] |
Dave P R, Ferraro L. Composition 2, 2, 4, 4, 6, 6-hexanitroadamantane: US 5202508 [P], 1993.
|
| [13] |
Paritosh R D, Little F. 4, 4, 6, 6-tetronitroadamantan-2-one: US 5180853 [P], 1993.
|
| [14] |
何志勇, 罗军, 吕春绪, 等. N2O5硝解DPT制备HMX[J].
火炸药学报, 2010, 33(2): 1-4. HE Zhi-yong, LUO Jun, Lü Chun-xu, et al. Synthesis of HMX from DPT by green nitrolysis with dinitrogen[J]. Chinese Journal of Explosives and Propellants, 2010, 33(2): 1-4. |
| [15] |
Hara T, Hatakeyama M, Kim A, et al. Preparation of clay-supported Sn catalysts and application to Baeyer-Villiger oxidation[J].
Green Chemistry, 2012, 14: 771-777. DOI:10.1039/c2gc16437j |
| [16] |
Wallentin C J, Orentas E, Butkus E, Wärnmark K. Baker's Yeast for sweet dough enables large-scale synthesis of enantiomerically pure bicyclo[3.3.1]nonane-2, 6-dione[J].
Synthesis, 2009, 5: 864-867. |
| [17] |
McCabe P H, Nelson C R, Routledge W. Acid-catalysed acylations of bicyclo[3.3.1]nonan-2, 6-diones: A novel preparation of the adamantane skeleton[J].
Tetrahedron, 1977, 33: 1749-1753. DOI:10.1016/0040-4020(77)84054-4 |
| [18] |
Yang N, Wu F, Gao J B, et al. Synthesis of 3-Methyl-2, 6-dimethylbicyclo[3.3.1]nonane-exo-2, exo-6-diol[J].
Synthetic Communications, 2009, 39: 3934-3939. DOI:10.1080/00397910902883561 |
| [19] |
Mislin G, Miesch M. Synthesis of polyfunctionalized bicycle[5.3.1]undecadiene ring systems using a two-carbon ring-expansion of cyclobutene intermediates[J].
European Journal of Organic Chemistry, 2001: 1753-1759. |

2, 2, 4, 4, 6, 6-Hexanitroadamantane was synthesized with a total yield of 3% using diethyl malonate and paraformaldehyde as raw materials by a process including cyclization, decarboxylation, ozonation, oximation and oxidative nitration.




