铝粉是一种能量密度高、理论比冲量大且经济耐用的金属粉末[1]。从20世纪40年代起,科学家就进行了铝水反应的相关研究[2]。目前, 该反应已被应用于鱼雷超空泡、水下推进系统以及新能源的制备[3-5]等。自20世纪90年代将纳米技术引入以来,应用纳米铝粉进行铝水反应已经得到很多研究人员的重视。研究者从反应条件[6-7]、反应中能量变化[8]、动力学[9]以及铝颗粒的性能[10-12]等方面进行了研究。然而,如何实现金属铝粉在水中的快速反应并提高反应释能,从而达到快速燃烧和高效能量转化,成为该技术广泛应用的关键。Grant A Risha等[13]设计了铝水雾化装置,并在绝氧气氛中点燃,通过测定火焰形貌和温度来表征铝粉的燃烧速率。也有研究人员使用反应釜[14]或类似绝热反应装置[15],来研究影响铝粉能量释放率或燃烧速率的因素。然而,这些研究均未能切实表征铝粉在水中的反应放热情况。在传统的探索微纳米热力学研究中,主要面临以下问题:(1)在传统量热器的装置中,微纳米粉体材料不可避免地会吸附空气中的水分和其他杂质,导致量热误差。(2)在热传导测定过程中,对粉体的施压会破坏材料的组织结构,进而破坏材料的密度、比热容等热力学参数。(3)在绝热装置中,不可能深入到反应内部本身去研究其反应放热。只能通过燃烧过程中火焰温度,或是对周围气氛的影响来间接表征反应物之间的热力学变化。
由于传统研究方法存在以上不足,所以反应中热力学函数的精确定量研究已成为亟待解决的一个课题,需要一种新的研究方法来对该反应进行分析。考虑到铝水反应作为一种氧化还原反应,其反应进程中复杂的电子得失过程可以用电化学方法进行分析。同时在反应热力学研究方面,电化学方法也可以精确定量研究铝水反应中的热力学函数。因此,可以探讨使用电化学手段对铝水反应进行研究。
由于电化学反应研究的特殊限制以及实际应用,本课题组主要研究了铝粉在NaCl溶液中的反应,探讨了不同温度下不同粒径的铝粉在3.5% NaCl溶液中的电化学行为。从电化学动力学和热力学的角度,分析了粒径对铝水反应的影响以及不同粒径铝粉在水反应中的能量释放情况,对铝水反应性能进行了量化研究,建立起使用电化学参数表征铝水反应的评价体系。
2 实验部分 2.1 试剂与仪器铝粉:四种粒径50 nm,2μm,13μm和29μm, 均由深圳尊业纳米技术有限公司生产。电化学工作站:华中科技大学化学学院CS300系列电化学工作站。
2.2 实验过程(1) 工作电极的制备
将导电玻璃切割为2.5 cm×2.5 cm的小块,将其置于酒精中浸泡24 h,用于除去导电玻璃表面的杂质。取出风干后,用银浆料将铜导线粘在导电玻璃的导电面端,并用环氧树脂将连接处密封。取一定量刚拆封的4种铝粉试样,分别与石墨按质量比为3:1混合,并滴入几滴聚四氟乙烯乳液(PTFE)。将粉末与乳液搅拌均匀,使其成为具有一定粘度的浆料。然后将浆料涂覆在导电玻璃的导电面上,并用一块干净的盖玻片盖上。将两片玻璃片用胶带固定,如图 1所示。将制备好的电极在室温下风干10 h。由于PTFE可以在空气中凝固,因此风干后浆料固化。
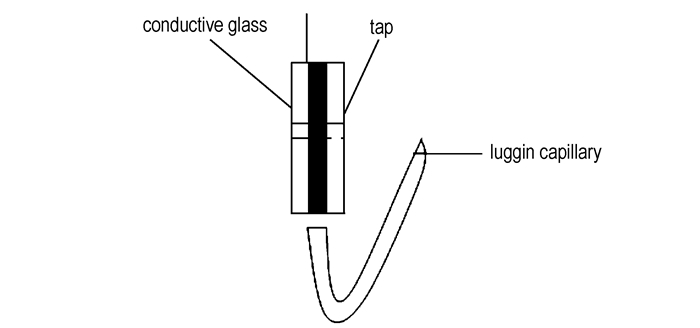
|
图 1 工作电极示意图 Fig.1 Schematic diagram of electrode |
(2) 在溶液中极化曲线的测定
试验中使用饱和甘汞电极(SCE)和铂电极分别作为参比电极和辅助电极。用该三电极体系在100 cm3的四口烧瓶中进行电化学实验。在每次试验之前,工作电极需在3.5% NaCl溶液中浸泡1 h。参比电极用鲁金毛细管连接,其尖端尽可能接近工作电极两玻璃之间的电极浆料层,但不要接触。将各个电极接在电化学工作站的相应接口上,并开始进行相应的极化曲线测试。
(3) Ecorr-T曲线的测定
使用恒温加热装置控制反应温度,将每组样品在20,22.5,25,27.5,30 ℃条件下分别测极化曲线,记录此时的腐蚀电位Ecorr。
3 结果与讨论 3.1 铝粉在NaCl溶液中的极化曲线将50 nm的Al粉在质量分数为3.5%的NaCl溶液中极化,极化区间为-1.9~0.4 V。极化结果如图 2所示。从图 2中可以看出,极化过程可以分为四个阶段。
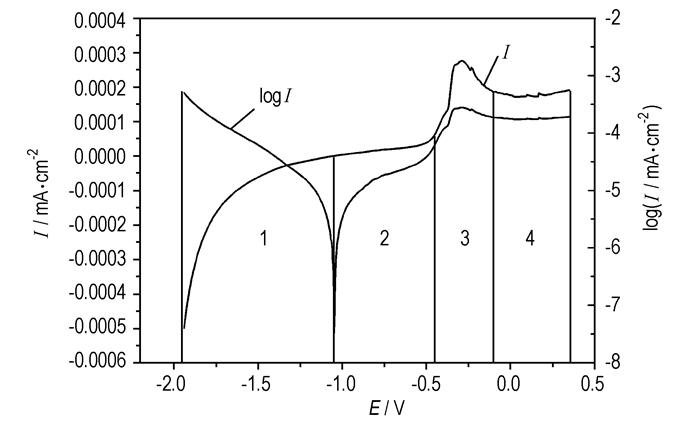
|
图 2 50 nm-Al在3.5% NaCl溶液中的极化曲线 Fig.2 Polarization curves for 50 nm-Al in 3.5% NaCl solution |
(1) -1.9~-1.04 V,阴极化区。工作电极上发生氢离子的还原反应:2H++2e→H2
(2) -1.04~-0.45 V,活化区。此时工作电极上发生Al的氧化,而辅助电极上发生H+的还原。
为了进一步说明这一阶段的电化学过程,我们将工作电极在-1.04 V和-0.5 V两个电势下恒电位腐蚀3 h。并对反应产物进行XRD分析,如图 3所示。由图 3可见在-0.5 V恒电位极化3 h后,工作电极上的氧化产物Al2O3多于在-1.04 V恒电位极化。该结果表明,铝粉在-1.04 V腐蚀电位附近极化时,其电化学反应可以看做是极其缓慢,对环境影响几乎不变的缓慢进行的过程。因此,在-1.04 V腐蚀电位附近的电化学反应可以近似看作平衡状态。
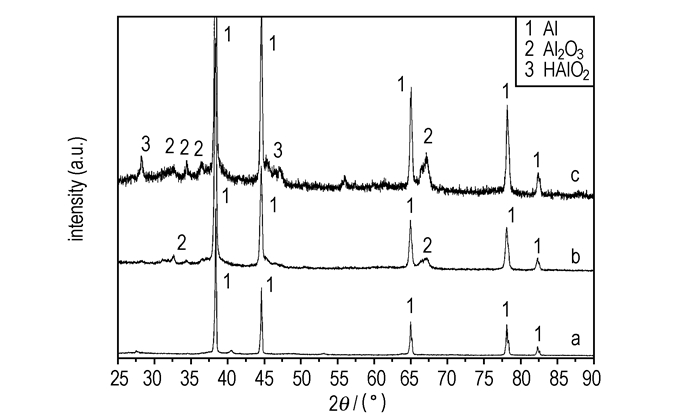
|
图 3 样品恒电位极化后XRD图 a—原料铝粉, b—1.04V恒电位极化下产物, c—0.5V恒电位极化下产物 Fig.3 X-ray diffraction patterns for the samples after constant potential polarization b—constant potential polarized powder under-1.04V, c—constant potential polarized powder under-0.5 V |
(3) -0.45~-0.15 V,阳极活化区以及钝化区。在这个阶段中,电极反应相对剧烈。因此,氧化层包覆在铝颗粒表面,并阻止内部活性铝进行反应。在这个过程中,极化电流突然增大,然后减小。由于Cl-的存在会促进氧化层的分解[18],氧化层可能会不断地形成、分解。在曲线上可能会表现出电流密度的波动性。
(4) 大于-0.15 V,过钝化区。铝颗粒表面覆盖了稳定的钝化层。此时,工作电极上的反应为析氧反应:4OH-→2O2+2H2O+4e-。
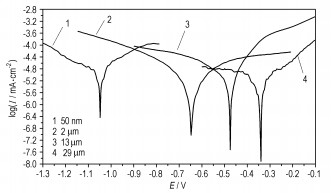
3.2 Al-H2O反应的电化学动力学分析图 4为25 ℃下,不同粒径大小的铝粉在3.5%NaCl溶液中的极化曲线。表 1为极化曲线中的各个电化学参数值(腐蚀电流密度Icorr,腐蚀电位Ecorr和Tafel斜率bc,ba)。
| 表 1 4种粒径铝粉在3.5% NaCl溶液中的极化曲线电化学参数 Tab.1 The electrochemical parameters associated with polarization measurements for the four samples in 3.5% NaCl solution at 25 ℃ |
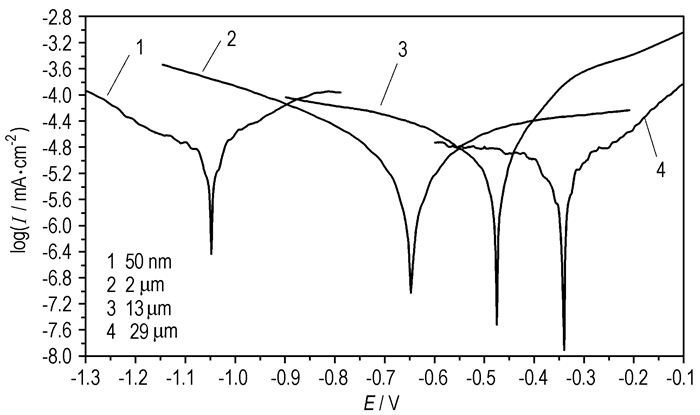
|
图 4 不同粒径铝粉在3.5% NaCl溶液中的极化曲线 Fig.4 Polarization curves for Al powder with different particle size in 3.5% NaCl solution at 25 ℃ |
由图 4和表 2可见,随着粒径的减小,腐蚀电流密度Icorr增大,腐蚀电位Ecorr呈负向增大趋势。此处的腐蚀电位Ecorr为Al-H2O反应达到稳定状态时所测得的电位。电化学动力学表明,离子电荷在Al颗粒与H2O(aq)的两相交界面上进行转移,伴随着电荷的转移,同时在相界面上发生物质的变化。在Al(s)/H2O(aq)界面上,电荷转移速率和物质变化速率相等,这一速率宏观上表现为化学反应速率,并通过电流密度来表示:Icorr =nFν。由此可见,腐蚀电流密度Icorr与反应速率呈正比。同时在Al-H2O反应过程中,由于Al颗粒表面附近的溶液电荷浓度较高,电极反应受到液相传质、电荷转移等的阻力,因此在不断反应的过程中会达到一个平衡状态,即固相到液相的电荷迁移速率与电荷向本体溶液中扩散速率相等。外加电场可改变电荷向本体溶液的扩散速率,即可通过外加电压表征反应的阻力。当外加电场阻碍电荷扩散,且这一扩散速率与固相到液相的电荷迁移速率相抵时,反应达到平衡状态。由此可见腐蚀电压Ecorr是表征反应克服界面阻力难易程度的一个参数。当Ecorr绝对值较大时,反应能够克服的阻力值较大,所对应的Al-H2O在自由反应时会比较剧烈。因此,图表中的数据表明,铝粉粒径越小, Al-H2O反应速率越大,反应越容易进行。通过上述分析,可以建立起利用Icorr表征Al-H2O反应的速率以及Ecorr表征反应能够克服的外界阻力值大小,即反应难易程度的评价体系。
| 表 2 不同粒径铝粉腐蚀电位Ecorr随温度T的变化 Tab.2 Ecorr of aluminum powder with different particle size at different temperatures |
Tafel斜率-bc, ba反映出电流密度I随外加电场E变化的快慢程度。由表 1可见,-bc, ba值几乎与粒径大小无关。这个结果表明,粒径的减小仅仅是由于接触面积的增大而使反应活性增加,其反应机理并没有改变。将25 ℃下腐蚀电位Ecorr与粒径D进行拟合(Ecorr-D),结果如图 5所示。
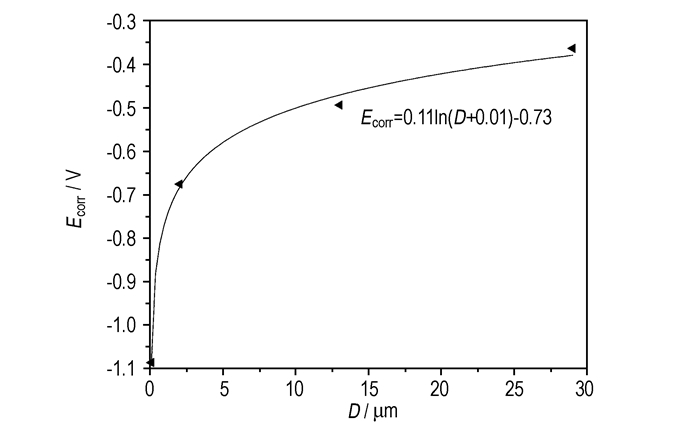
|
图 5 25 ℃下腐蚀电位Ecorr随粒径变化的拟合曲线 Fig.5 The fitted curve of Ecorr with particle size at 25 ℃ |
由图 5可见,D与Ecorr成近似对数关系,随着粒径的减小,腐蚀电位随之减小。当粒径小于2μm时,Ecorr与D的关系几乎呈斜率较大的直线,表明在此范围内减小颗粒的粒径对Ecorr的影响更加明显。其原因主要是纳米级铝粉存在一定的纳米效应,在制备过程中对颗粒注入较高的能量。纳米铝具有较高的比表面积以及较大的表面缺陷能,是一种亚稳态金属粉末。在纳米尺度范围减小颗粒粒径,会使比表面积成倍增长,与水分子接触面积随之增大,因此对反应的影响较为明显。
3.3 温度对Al-H2O反应的影响腐蚀电位温度系数(
为求得不同粒径腐蚀电位温度系数
| $ {\rm{50}}\;{\rm{nm:}}\;{\mathit{E}_{{\rm{corr}}}}{\rm{ = 8}}{\rm{.4571 \times 1}}{{\rm{0}}^{{\rm{ - 6}}}}{\mathit{T}^{\rm{2}}}{\rm{ - 0}}{\rm{.0583}}\mathit{T}{\rm{ + 8}}{\rm{.8033}} $ | (1) |
| $ {\rm{2}}\;{\rm{ \mathsf{ μ} m:}}\;{\mathit{E}_{{\rm{corr}}}}{\rm{ = 2}}{\rm{.2857 \times 1}}{{\rm{0}}^{{\rm{ - 6}}}}{\mathit{T}^{\rm{2}}}{\rm{ - 0}}{\rm{.0067}}\mathit{T}{\rm{ + 1}}{\rm{.1504}} $ | (2) |
| $ {\rm{13}}\;{\rm{ \mathsf{ μ} m:}}\;{\mathit{E}_{{\rm{corr}}}}{\rm{ = 8}}{\rm{.6857 \times 1}}{{\rm{0}}^{{\rm{ - 5}}}}{\mathit{T}^{\rm{2}}}{\rm{ - 0}}{\rm{.0563}}\mathit{T}{\rm{ + 8}}{\rm{.5796}} $ | (3) |
| $ {\rm{29}}\;{\rm{ \mathsf{ μ} m:}}\;{\mathit{E}_{{\rm{corr}}}}{\rm{ = 4}}{\rm{.1143 \times 1}}{{\rm{0}}^{{\rm{ - 5}}}}{\mathit{T}^{\rm{2}}}{\rm{ - 0}}{\rm{.0283}}\mathit{T}{\rm{ + 4}}{\rm{.4321}} $ | (4) |
可以看出,在20~30℃条件下腐蚀电位Ecorr随温度T呈二次函数关系,不同粒径的Ecorr-T方程系数不同。由以上方程即可求得
| 表 3 25 ℃下电化学研究铝水反应的热力学参数 Tab.3 The thermodynamic parameters obtained by electrochemical analysis for the reaction of Al-H2O at 25 ℃ |
铝水反应放热量是决定铝粉作为水冲压燃料性能优劣的一个重要技术指标。科学家在研究活性金属粉末在NaCl溶液中水反应制氢的课题中发现,金属粉末在NaCl溶液中的主要反应依然是与水分子的反应,虽然氯离子对金属氧化物的水解有一定促进作用,但铝粉在3.5% NaCl水溶液中进行的主要反应如下[16-18]:Al+H2O→Al2O3+H2, ΔH=-410 kJ·mol-1 (298.15 K, 1 atm)。
由该反应式可知,1 mol Al参与反应,对应电子转移数为3 mol,即z=3。根据法拉第定律和吉布斯-亥姆霍兹方程式可知,在电化学平衡态有如下方程:
| $ {{{\rm{\Delta }}_{\rm{r}}}{\mathit{G}_{\rm{m}}}{\rm{ = }}{{\left( {\frac{{\partial {{\rm{\Delta }}_{\rm{r}}}\mathit{G}}}{{\partial \mathit{\xi }}}} \right)}_{\mathit{T}{\rm{, }}\mathit{p}}}{\rm{ = - }}\mathit{zF}{\mathit{E}_{{\rm{corr}}}}} $ | (5) |
| $ {{{\rm{\Delta }}_{\rm{r}}}{\mathit{S}_{\rm{m}}}{\rm{ = }}\mathit{zF}{{\left( {\frac{{\partial {\mathit{E}_{{\rm{corr}}}}}}{{\partial \mathit{T}}}} \right)}_\mathit{p}}} $ | (6) |
| $ {{{\rm{\Delta }}_{\rm{r}}}{\mathit{H}_{\rm{m}}}{\rm{ = }}{{\rm{\Delta }}_{\rm{r}}}{\mathit{G}_{\rm{m}}}{\rm{ + }}\mathit{T}{{\rm{\Delta }}_{\rm{r}}}{\mathit{S}_{\rm{m}}}{\rm{}}} $ | (7) |
式中,ΔrGm为反应的吉布斯自由能变化量,单位为kJ·mol-1;z为单位摩尔电子转移数;F为法拉第常数; T为温度,单位为K;ΔrSm为反应熵变,单位为kJ·mol-1;ΔrHm为反应焓变,单位为kJ·mol-1。
由于处于腐蚀电位附近的工作电极处于平衡状态,则由以上方程可对25 ℃条件下,反应中的ΔrGm、ΔrSm以及ΔrHm进行求解。其结果列于表 3中。燃烧效率η由方程(8)得出:
| $ \mathit{\eta }{\rm{ = }}\frac{{{{\rm{\Delta }}_{\rm{r}}}{\mathit{H}_{\rm{m}}}}}{{{\rm{\Delta }}\mathit{H}}}{\rm{ \times 100\% }} $ | (8) |
式中,ΔH 为理论的摩尔焓变,kJ·mol-1;ΔrHm为实际反应中的摩尔焓变,kJ·mol-1。
由表 3可见,实际的铝粉的燃烧焓ΔrHm并不能达到理论值(ΔH=-410 kJ·mol-1),50 nm的铝粉与水的反应有较高的燃烧效率,可达到90.6%,而29 μm铝粉的燃烧率仅54.9%。可以利用这一参数表征铝水反应放热情况,即随着粒径的减小,反应的放热量越大。这一结果可以较好地指导Al-H2O反应的实际应用。无论哪种颗粒大小的铝粉,目前的技术都无法完全解决反应过程中致密氧化膜包覆而导致的燃烧不完全问题。然而,在考虑到贮存过程中的氧化变质等因素,纳米铝在水中的反应已接近完全,这个结果反映出纳米铝在水冲压发动机应用中的巨大潜力。
4 结论从电化学角度对Al-H2O反应进行研究,用Al-H2O反应腐蚀电位Ecorr表征反应难易程度。分析了粒径和温度对Ecorr的影响,并得到了Ecorr-D及Ecorr-T关系式。结果表明当粒径小于2μm时,粒径的减小对反应的影响较为显著。对反应热力学的研究表明,粒径为50 nm的铝粉燃烧率达到90%以上。具体结果如下:
(1) Al-H2O反应极化过程可分为四个阶段:阴极化区、活化区、阳极活化区及钝化区、过钝化区。通过恒电位极化分析可得,在腐蚀电位-1.04 V附近,工作电极上的极化过程是极其缓慢的一个近似平衡态。
(2) 不同粒径铝粉在3.5% NaCl溶液中的极化曲线表明,随着粒径的减小,腐蚀电流密度Icorr增大,腐蚀电压Ecorr负向增大,Tafel斜率bc, ba由于反应机理的不变而保持基本不变。建立了以Icorr和Ecorr表征Al-H2O反应速率以及反应难易程度的评价体系。由此可知,随着粒径减小Al-H2O反应越剧烈。特别当颗粒小于2μm时,粒径的减小对反应的影响较为显著。
(3) 在20~30 ℃范围内,随着温度的升高,Ecorr负向增大,反应越剧烈。且由拟合结果知,该温度范围内,Ecorr与温度T呈二次函数关系。并建立了腐蚀电位温度系数
(4) 铝水反应电化学热力学分析表明, 铝颗粒粒径越小,反应放热越大。25 ℃下50 nm铝粉在铝水反应中反应放热值达-371.36 kJ·mol-1,相对应的燃烧效率为90.6%,远大于2 μm铝粉的66.7%。说明,可用反应燃烧焓表征Al粉在Al-H2O反应中能量释放,并表明,纳米铝在实际应用中具有更好的发展前景。
| [1] |
周杰, 王树宗. 超空泡鱼雷推进系统相关问题设计初探[J].
鱼雷技术, 2006, 14(5): 27-30. ZHOU Jie, WANG Shu-zong. Discussion on design of supercavitating torpedo propulsion[J]. Torpedo technology, 2006, 14(5): 27-30. |
| [2] |
郑邯勇. 铝水推进系统的现状与发展前景[J].
舰船科学技术, 2003, 25(5): 24-25. ZHENG Han-yong. Development of the aluminum-water power system[J]. Ship Science And Technology, 2003, 25(5): 24-25. |
| [3] |
Franzoni F, Milani M, Montorsi L, et al. Combined hydrogen production and power generation from aluminum combustion with water: Analysis of the concept[J].
Int J Hydrogen Energy, 2010, 35(4): 1548-1559. DOI:10.1016/j.ijhydene.2009.11.107 |
| [4] |
Shafrovich E, Diakov V A. Combustion of novel chemical mixtures for hydrogen generation[J].
Combust Flame, 2006, 144: 415-418. DOI:10.1016/j.combustflame.2005.07.018 |
| [5] |
Huang Y, Risha G A, Yang V, et al. Analysis of nano-Aluminum particle dust cloud combustion in different oxidizer environments[C]//43th AIAA Aerospace Sciences Meeting and Exhibit, Reno, NV, 2005.
|
| [6] |
Czech E, Troczynski T. Hydrogen generation through massive corrosion of deformed aluminum in water[J].
Int J Hydrogen Energy, 2010, 35(3): 1029-1037. DOI:10.1016/j.ijhydene.2009.11.085 |
| [7] |
Mahmoodi K, Alinejad B. Enhancement of hydrogen generation rate in reaction of aluminum with water[J].
Int J Hydrogen Energy, 2010, 35(11): 5227-5232. DOI:10.1016/j.ijhydene.2010.03.016 |
| [8] |
Barcia S Á, Floresa J R. The interaction of Al atoms with water molecules: a theoretical study[J].
J Chem Phys, 2009, 131: 174307 DOI:10.1063/1.3253049 |
| [9] |
Miller T F, Herr J D. Green rocket propulsion by reaction of Al and Mg powders and water[C]//40th AIAA/ASME/SAE/ASEE Joint Propulsion Conference and Exhibi, Fort Lauderdale, Florida, 2004.
|
| [10] |
Armstrong R W, Baschung B, Booth D W, et al. Enhanced propellant combustion with nanoparticles[J].
Nano Letters, 2003, 3(2): 253-255. DOI:10.1021/nl025905k |
| [11] |
Luman J R, Wehrman B, Kuo K K, et al. Development and characterization of high performance solid propellants containing nano-sized energetic ingredients[J].
P Combust Inst, 2007, 31(2): 2089-2096. DOI:10.1016/j.proci.2006.07.024 |
| [12] |
Watanabe M. Chemical reactions in cracks of aluminum crystals: generation of hydrogen from water[J].
J Phys Chem Solids, 2010, 71(9): 1251-1258. DOI:10.1016/j.jpcs.2010.05.002 |
| [13] |
Risha G A, Huang Y, Yetter R A, et al. Combustion of aluminum particles with steam and liquid Water[C]//44th AIAA Aerospace Sciences Meeting and Exhibit, Reno, NV, 2006.
|
| [14] |
万俊, 蔡水洲, 刘源, 等. 推进剂用铝粉与水反应特性研究[J].
固体火箭技术, 2012, 25(2): 207-211. WAN Jun, CAI Shui-zhou, LIU Yuan, et al. Study on reaction characteristic of aluminum powder with water applied to propellant[J]. Journal of Solid Rocket Technology, 2012, 25(2): 207-211. |
| [15] |
Trunov Mikhaylo A, Schoenitz M, Dreizin Edward, et al. Ignition of aluminum powders under different experimenta conditions[J].
Propellants Explosives Pyrotechnics, 2005, 30(1): 36-43. DOI:10.1002/(ISSN)1521-4087 |
| [16] |
Black S A, Jenkins J F. Powdered metal source for production of heat and hydrogen gas: US 4017414[P]. 1977.
|
| [17] |
Soler L, Candela A M, Macanas J, et al. Hydrogen generation by aluminum corrosion in seawater promoted by suspensions of aluminum hydroxide[J].
Int J Hydrogen Energy, 2009, 34(20): 8511-8518. DOI:10.1016/j.ijhydene.2009.08.008 |
| [18] |
Sayed S A, Hassan H H, Amin M A. Corrosion inhibition study of pure Al and some of its alloys in 1.0 M HCl solution by impedance technique[J].
Corros Sci, 2004, 46(1): 5-25. DOI:10.1016/S0010-938X(03)00133-1 |
Al powder with 50 nm, 2 μm, 13 μm and 29 μm was studied from the perspective of electrochemistry. The behaviours of Al-H2O reaction affected by particle size and temperature were discussed. The electrochemical thermodynamic parameters of Al-H2O reaction were calculated.




