2. 北京化工大学化学工程学院, 北京 100029
2. Chemical Engineering College, Beijing University of Chemical Technology, Beijing 100029, China
氟氮含能材料是指分子结构中含有二氟氨基(—NF2)的化合物或聚合物。由于N—F键具有较低的键能(280 kJ·mol-1),二氟氨基含能物质在燃烧分解过程中形成的气体产物HF键能高(565 kJ·mol-1),相对分子质量低,生成热高,可极大地提高发射药、推进剂和混合炸药的能量水平,是其最为理想的组分之一,在冲压发动机及高速拦截导弹使用的高能推进剂中有较好的应用前景[1-2]。20世纪90年代以来,国外开展了一些新型氟氮含能材料的研究工作[3-9],其中较具代表性的是美国Aerojet General公司开发的具有环氧丁烷母环的二氟氨基化合物。该类二氟氨基化合物中独特的新戊基(CH3)3CCH2—结构能有效稳定—NF2,阻止HF气体放出,使得这类二氟氨基化合物具有良好的安定性和低的撞击感度[9]。3, 3-双(二氟氨甲基)氧杂环丁烷(BDFAO)是具有环氧丁烷母环的二氟氨基化合物的代表品种,其具有图 1所示的分子结构。
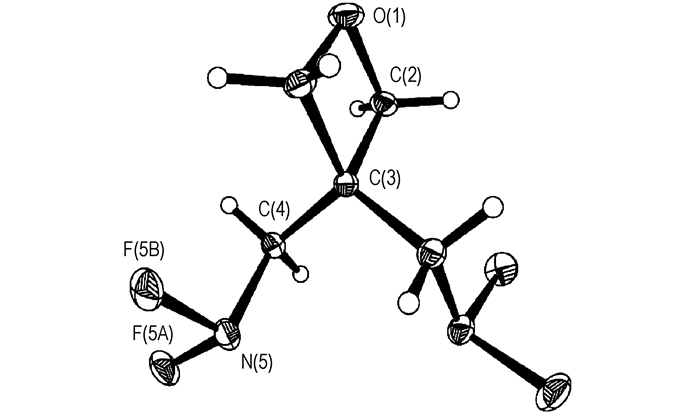
|
图 1 BDFAO分子结构 Fig.1 Molecule structure of BDFAO |
文献[9]报道的BDFAO室温下是白色固体结晶,熔点43~44 ℃,—NF2含量56%,化学稳定性好。BDFAO是合成新型氟氮聚合物的重要单体,可与四氢呋喃、3-二氟氨甲基-3-甲基氧杂环丁烷(DFAMO)、3-叠氮甲基-3-甲基氧杂环丁烷(AMMO)等单体通过阳离子聚合来合成不同性能的高能固体推进剂用黏合剂[9-10]。将BDFAO用100%硝酸在二氯甲烷中硝化,可制备2,2-双(二氟氨甲基)-1,3-丙二醇二硝酸酯高能增塑剂[11]。
为了给新型氟氮含能聚合物的研究提供基础材料,以3, 3-二氯甲基氧杂环丁烷(BCMO)为起始原料,通过胺化、酯化、氟化反应合成出粗品BDFAO,采用低温结晶法将BDFAO粗品提纯,制得质量分数大于97%的BDFAO。采用红外光谱、核磁共振、元素分析、气相色谱、热重-差热、感度测试等分析手段对BDFAO的结构和性能进行了研究,为氟氮聚合物的合成打下了基础。
2 实验部分 2.1 原料与试剂BCMO(工业级)、液氨(工业级)、氟气(工业级)、氯代甲酸乙酯(化学纯)、氢氧化钠(分析纯)、乙腈(分析纯)。
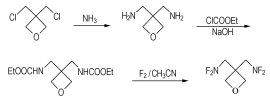
2.2 合成方法BDFAO的合成路线见Scheme 1。
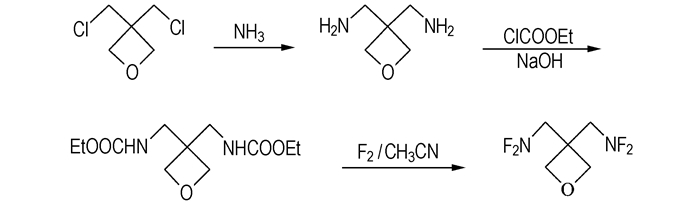
|
Scheme 1 Synthetic route of BDFAO |
将适量的BCMO加入到不锈钢高压反应釜中,N2充分置换后,通入足量的液氨,搅拌下于约85 ℃、压力3.8 MPa下反应12 h,将所得反应物料通过过滤、真空蒸馏等操作处理,得到室温下为液体的3, 3-双(氨甲基)氧杂环丁烷。将制得的3, 3-双(氨甲基)氧杂环丁烷加入到NaOH水溶液中,搅拌,冷却至约0 ℃,向其中缓慢滴加定量的氯甲酸乙酯,保持反应温度≤2 ℃。氯甲酸乙酯滴完后,继续使体系温度≤2 ℃维持1 h,然后,经萃取、水洗、干燥、过滤,脱溶剂、重结晶等处理,得到白色粉末状固体3, 3-双(甲氨基甲酸乙酯)氧杂环丁烷。将3, 3-双(甲氨基甲酸乙酯)氧杂环丁烷溶于乙腈中在低温下用伴氮氟气(V(CF2)/V(N2)=1/9)氟化,氟化产物经处理得到淡黄色粗品BDFAO结晶,氟化及处理方法基本同文献[9]。粗品BDFAO在溶剂中于低温(-30 ℃)下重结晶,得到高纯度的BDFAO。
2.3 分析仪器及测试条件NMR采用德国Bruker公司Av400超导核磁波谱仪,用氘代三氯甲烷作为溶剂。IR采用Bruker公司VERTEX-70型光谱仪,溴化钾盐片晶体涂膜。热分析采用Dupont 2010型TG-DTA分析仪,程序升温速率10 ℃·min-1,氮气流速150 ms·min-1。元素分析使用德国Elementar公司Vario ELⅢ型有机微量元素分析仪。BDFAO纯度采用金羊TL9000气相色谱仪分析:汽化温度200 ℃,柱温200 ℃,检测器温度210 ℃,进样量10 μL。撞击感度采用国产ZBL-B型撞击感度测试仪,落锤质量5 kg,试样药量50 mg/次,按国军标GJB772A-1997.601.1方法测定;摩擦感度采用国产BM-B型摩擦感度仪,摆角90°,试样压力3.92 MPa,药量20 mg,按国军标GJB772A-1997.602.1方法测定。
3 结果与讨论 3.1 BDFAO样品制备文献[9]中BDFAO的合成是以3, 3-双(氨甲基)氧杂环丁烷为起始原料,国内没有市售品,通过BCMO的氨化反应制备了纯度大于99.0%的3, 3-双(氨甲基)氧杂环丁烷,收率68%。3, 3-双(氨甲基)氧杂环丁烷与氯代甲酸乙酯的反应放热量较大,关键是要控制好氯代甲酸乙酯的滴加速度,及时移除反应热,控制反应在0 ℃左右进行,该步反应产物收率较高,3, 3-双(甲氨基甲酸乙酯)氧杂环丁烷精品收率在92%左右(文献报道粗品收率98%[9])。氟化反应是合成BDFAO的关键,使用浓度10%(体积)的伴氮氟气、控制气体流量200~300 cm3·min-1、氟化温度-20~-25 ℃、氟化时间10~15 h制得了纯度为92%左右的粗品BDFAO,收率80%(和文献[9]报道的83%粗品收率相当)。文献[9]在50~60 ℃、6.66 Pa高真空下使粗品BDFAO升华,收集升华冷凝物得到高纯度BDFAO。研究表明该方法操作条件苛刻,不适用于大量粗品BDFAO的提纯,我们成功地于低温下使粗品BDFAO在溶剂中结晶提纯,制得纯度大于97%的BDFAO,提纯收率达到85%。BDFAO合成总收率在43%左右。合成的BDFAO常温下是白色结晶物,其外观数码照片如图 2所示。

|
图 2 BDFAO的外观数码照片 Fig.2 The DC photo of BDFAO appearance |
需要强调的是在BDFAO合成中应重点做好防爆、防毒等安全防护工作。3, 3-双(氨甲基)氧杂环丁烷的制备需使用液氨,且在较高压力下进行,危险性较大。使用的氯甲酸乙酯、氟气属剧毒危化品,要做好安全使用与防护。合成的BDFAO是含能物质,其摩擦感度较高,应格外小心操作与处理,防止爆炸事故发生。
3.2 表征与性能 3.2.1 红外分析BDFAO的红外光谱数据未见文献报道。对合成的BDFAO进行了IR测定,红外吸收光谱如图 3所示。图中吸收峰的归属分析如下:波数2900 cm-1附近为氧杂环丁烷环上—CH2的C—H伸缩振动吸收峰;1755 cm-1处为强的NF2基团特征吸收峰,1270 cm-1处为环醚的C—O键伸缩振动吸收峰,992 cm-1处为环醚的分子骨架吸收峰,812 cm-1处为C—N键伸缩振动吸收峰。IR图谱表明,合成产物具有目标产物BDFAO的结构特征。
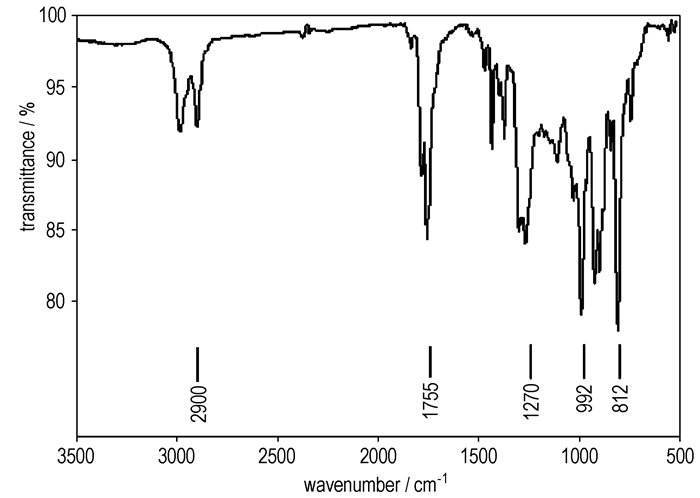
|
图 3 BDFAO的红外图谱 Fig.3 IR spectra of BDFAO |
对合成的BDFAO样品分别进行了氢、碳核磁共振测定,其1H NMR谱图如图 4所示,13C NMR谱图如图 5所示。从1H NMR谱图可以看出,化学位移4.60处是BDFAO分子中氧杂环丁烷环上2个亚甲基的1H原子核的共振吸收峰,该氢核受—NF2的影响很弱,呈现一较强的共振单峰;而直接与—NF2基团相连的两个亚甲基的1H原子核由于受到—NF2强吸电子基团的影响,在化学位移4.00处裂分为三重峰,4个峰的面积比为3.98:1.00:1.99:1.03≈4:1:2:1, 与理论值一致。13C NMR谱图在化学位移39.49处是BDFAO分子中季碳原子核的共振单峰,67.4处为与NF2基团相连的2个亚甲基的碳原子核的共振三峰,77.23处为氧杂环丁烷环上2个亚甲基的碳原子核的共振三峰,分别对应于BDFAO分子结构中三种不同的碳核化学环境,与目标产物BDFAO结构十分吻合。合成的BDFAO的1H NMR和13C NMR谱图与文献报道值(1H NMR 4.00(t,4H),4.60(s,4H);13C NMR 39.490,67.398(t,2C),77.230(t,2C))一致[9]。
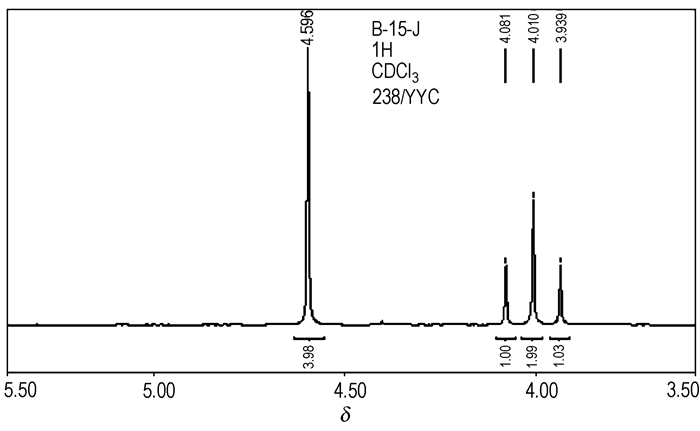
|
图 4 BDFAO的1H NMR Fig.4 1H NMR of BDFAO |
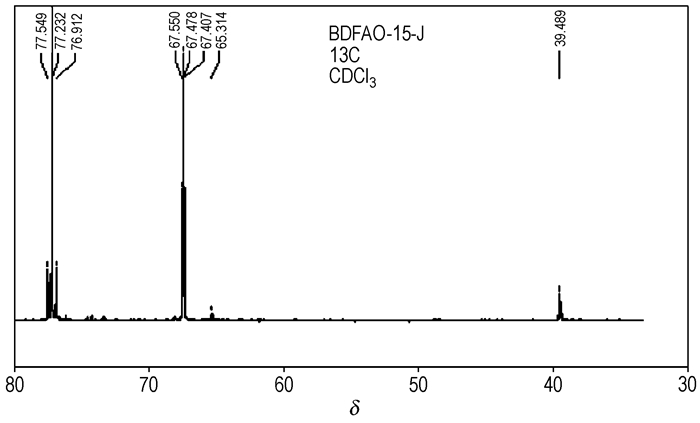
|
图 5 BDFAO的13C NMR Fig.5 13C NMR of BDFAO |
对合成的不同批次的BDFAO样品的C、H、N元素含量进行了测定,测定值与理论值对比见表 1。文献中未见有关BDFAO纯度及其分析方法的报道,采用气相色谱对BDFAO纯度进行了分析,由于BDFAO常温下是固体,将其先用乙腈溶解,配成质量分数为20%左右的溶液,采用溶液进样方式有效解决了进样困难问题。由于BDFAO的升华作用,其在200 ℃的汽化室中迅速汽化为BDFAO气体,可方便地检测得到。不同批次的BDFAO样品的纯度分析结果见表 1。
| 表 1 BDFAO的元素分析及纯度 Tab.1 Elementary analysis and purity of BDFAO |
从表 1可以看出,研究初期合成的BDFAO样品(1和2)纯度相对较低,其N含量与理论值偏差相对大一些。后期合成的样品3、4的纯度均在98%以上,其C、H、N含量与理论值接近。
3.2.4 热分析使用TG-DTA联用分析仪测定了BDFAO热性能,结果如图 6所示。从BDFAO的DTA曲线可以看出,BDFAO的熔点为43.5 ℃(43~44 ℃[9]),其在120 ℃有一较小的吸热峰,是其升华吸热所致。DTA曲线上未呈现放热峰,表明在15~200 ℃测试温度范围内BDFAO未发生分解(文献报道的BDFAO初始热分解温度为208 ℃[9]),BDFAO的热稳定性较好。TG曲线表明,BDFAO从46 ℃左右即有失重发生,温度达到70 ℃以上时,失重速率加剧,在130 ℃时失重达到94%,这主要是由于BDFAO的升华作用造成的。
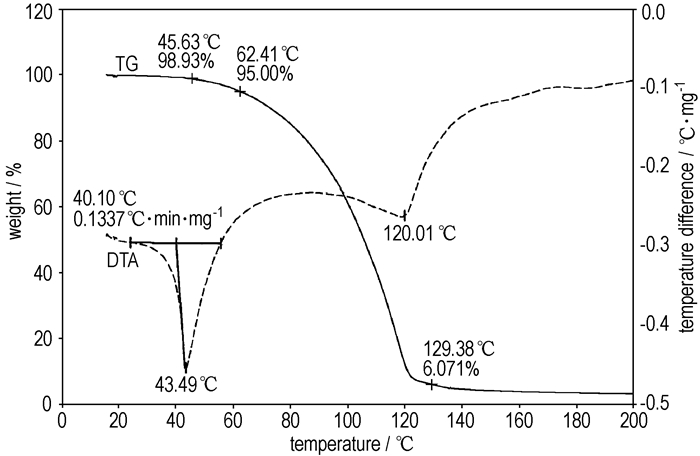
|
图 6 BDFAO的TG-DTA曲线 Fig.6 TG-DTA curves of BDFAO |
按国军标GJB772A-1997中601.1和602.1的方法分别测定了不同批次的BDFAO的撞击感度(5 kg落锤)和摩擦感度(摆角90°,压力3.92 MPa)。结果见表 2。
| 表 2 BDFAO的撞击感度和摩擦感度 Tab.2 Impact and friction sensitivity of BDFAO |
文献[9]给出的BDFAO的撞击感度H50仅是一范围:大于100 cm(2 kg落锤),而其摩擦感度数据未见文献报道。由表 2可以看出,四个BDFAO样品的平均H50≈28.5 cm(5 kg落锤),说明BDFAO是一种对撞击较为钝感的含能材料。而纯度相对较低的样品1和2的撞击感度特性落高H50和纯度大于98%的BDFAO样品(3和4)的H50差别不大,说明BDFAO样品中的少量杂质对BDFAO的撞击感度影响甚小。测定的四个BDFAO样品的摩擦感度均为100%,表明BDFAO是对摩擦较为敏感的含能物质,因此,在对BDFAO进行转移、贮存、运输等操作处理时一定要防止摩擦与振动,防止爆炸事故发生。
4 结论(1) 以3, 3-二氯甲基氧杂环丁烷(BCMO)为起始原料,通过氨化、酯化、氟化反应合成出纯度大于97%的BDFAO,总收率约43%。
(2) 利用红外光谱、核磁共振、元素分析对合成产物进行了表征:首次给出了BDFAO的红外光谱数据;合成的BDFAO的1H NMR和13C NMR数据与文献报道值一致;C、H、N元素分析结果与理论值吻合。确定合成产物为目标产物BDFAO。
(3) 合成的BDFAO的熔点为43.5 ℃,在15~200 ℃范围内BDFAO不发生分解作用,其热稳定性良好。
(4) BDFAO的撞击感度H50≈28.5 cm(5 kg落锤),摩擦感度为100%(摆角90°,压力3.92 MPa)。BDFAO是一种对撞击钝感、但对摩擦较为敏感的含能化合物。
| [1] |
Gregory Young, Kenneth K Kuo. Characterization of combustion and propulsive behavior of NF2-based solid propellants[C]//50th JANNAF Propulsion Meeting. Salt Lake City, USA. 2001: 287-303.
|
| [2] |
David C Sayles, Huntsville Ala. Composite rocket propellant composition with a controllable pressure exponent: US 5059260[P], 1997.
|
| [3] |
Prakash G K Surya, Etzkorn Markus, Olah George A, et al. Triphenylmethyldifluoramine: A stable reagent for the synthesis of gem-bis(difluoramines)[J].
Chemical Communications, 2002(16): 1712-1713. DOI:10.1039/B203811K |
| [4] |
Politzer Peter, Lane Pat. Computational studies of structures and properties of energetic difluoramines[J].
Advances in Molecular Structure Research, 1997(3): 269-285. |
| [5] |
Dalinger Igor L, Vinogradov Vasilii M, Shevelev Sv'yatoslav A. Synthesis and calculation of properties of N-(difluoroamino)azoles, the novel type of energetic materials[J].
Propellants, Explosives, Pyrotechnics, 1998, 23(4): 212-217. DOI:10.1002/(ISSN)1521-4087 |
| [6] |
Robert D Chapman, Matthew C Davis, Richard Gilardi. A new preparation of gem-bis(difluoramino)-alkanes via direct fluorination of geminal bisacetamides[J].
Synthetic Communications, 2003, 33(23): 4173-4184. DOI:10.1081/SCC-120026361 |
| [7] |
Prakash Surya G K. Synthesis of 1, 3-bis(N, N'-difluoroamino)adamantane: Addition of difluoroamino radicals to 1, 3-dehydroadamantane[J].
Journal of Fluorine Chemistry, 2002, 117: 103-105. DOI:10.1016/S0022-1139(02)00155-0 |
| [8] |
FAN Xiao-wei, JU Xue-hai, XIAO He-ming, et al. Theoretical studies on heats of formation, group interactions, and bond dissociation energies in neopentyl difluoroamino compounds[J].
Journal of Molecular Structure, 2006, 801: 55-62. DOI:10.1016/j.theochem.2006.08.057 |
| [9] |
Archibald Thomas G, Manser Gerald E, Immoos John E. Difluoroamino oxetanes and polymers formed therefrom for use in energetic formulations: US 5420311[P], 1995.
|
| [10] |
Malik Aslam A, Archibald Thomas G, Carlson Roland P, et al. Polymerization of energetic, cyclic ether monomers using boron trifluoride tetrahydrofuranate: US 5468841[P], 1995.
|
| [11] |
Archibald Thomas G, Manser Gerald E. Neopentyl difluoroamino compounds for use in energetic formulations: US 5789617[P], 1998.
|
3, 3-Bis(difluoroaminomethyl)oxetane(BDFAO)was synthesized from 3, 3-bis(chloromethyl)oxetane(BCMO) and was characterized by IR, 1H NMR, 13C NMR, GC and elemental analysis. The thermal properties of synthesized BDFAO were investigated by TG-DTA(thermogravimetry and differential thermalanalysis). Its sensitivities were determined by GJB772A-1997.



