2. 中国工程物理研究院化工材料研究所,四川 绵阳 621900
2. Institute of Chemical Materials, CAEP, Mianyang 621900, China
3, 7-二硝基-1, 3, 5, 7-四氮杂双环[3.3.1]壬烷(DPT)是制备高能炸药奥克托今(HMX)的关键性中间体[1],虽然,硝解制备HMX的工艺研究已有不少报道[2-7],但是产物HMX的总体收率不超过60%。主要是因为该硝解过程复杂,副产物较多,目前,关于硝解副产物及其机理研究的文献报道较少,早期McKay[8]等研究发现,当DPT在硝酸-硝酸铵系统中反应时能生成一定量的HMX,但如果其中的硝酸铵被酸酐(如N2O5或醋酐)取代,反应中酸酐将作为酯化试剂参与反应,产物以直链产物为主,没有环状产物HMX生成。我们在工艺研究中也发现[9],随着N2O5用量的增加,HMX收率增加,但当N2O5浓度达到一定程度,HMX的收率又随之降低。目前,硝解DPT制备HMX已成为研究的热点,对其副产物进行分离和鉴定可以更好地分析其反应历程和机理,可以更好地指导硝解DPT制备HMX的生产。本实验主要针对N2O5硝解DPT制备HMX中的副产物进行了分离,得到了两个副产物,进行了结构表征,同时对其硝解机理进行了分析。
2 实验部分 2.1 试剂与仪器HNO3、P2O5为化学纯,其它试剂为分析纯,N2O5自制。
WRS-1B数字熔点测定仪(上海精密科学仪器有限公司);MB154S型红外光谱仪(加拿大Boman公司),KBr压片;300 MHz核磁共振仪(德国Bruker-Daltonik公司),内标为四甲基硅烷;Finnigan Trace TSQ高分辨质谱仪(美国ThemoElectron公司);VARIO EL Ⅲ元素分析仪(德国elementar公司)。
2.2 实验过程 2.2.1 DPT的合成在0 ℃向三口烧瓶中加入95%的硝酸和20%的发烟硫酸,充分混合后,于-5 ℃加入脲,保温反应1 h,加入37%的甲醛溶液,控制温度低于20 ℃。然后升温至40 ℃保温反应30 min,反应结束加入25%氨水溶液进行中和,调节pH值为6,于20 ℃保温40 min。过滤,水洗,干燥,得白色固体粉末(DPT)。
2.2.2 N2O5硝解DPT副产物的分离将一定浓度N2O5/HNO3溶液(2 g N2O5和21.9 g HNO3)倒入四口烧瓶中,强烈搅拌,用冷冻低温循环槽保持体系温度低于0 ℃,加入1.85 g NH4NO3,待溶解后将2 g DPT分批加入上述体系中,控制温度0~5 ℃,加料时间10 min,然后将反应混合物于25 ℃反应10 min。
将上述溶液倒入含有33 g NaHCO3的冰水溶液中,搅拌中和后,用二氯甲烷450 mL分3次萃取,合并有机层,用20 g无水Na2SO4干燥,于40 ℃减压蒸除溶剂(-0.095 MPa)得到白色固体样品0.875 g(样品1)。以二氯甲烷和石油醚混合液为洗脱剂,柱层析分离出副产物。
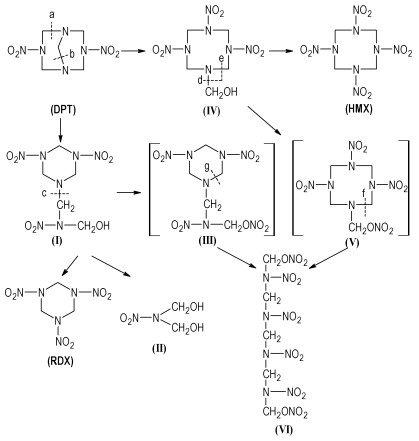
3 结果与讨论DPT硝解过程中硝解产物复杂,除了形成六元和八元环化合物外还有开环反应形成直链化合物,许多产物结构相近,同时有些产物不稳定,没有紫外吸收,这直接影响柱层析分离时洗脱剂比例的选择,从而导致分离出来的物质纯度并没有预计的那么高。我们将分离所得的样品1用二氯甲烷溶解点板,以1:1二氯甲烷和石油醚(体积比)为展开剂,同时用原料DPT和最终产品HMX对照点板(图 1),样品1中至少有5种组分,其中HMX在该展开剂中跑不动,组分E是原料DPT。以1:2的二氯甲烷和石油醚(体积比)为洗脱剂过硅胶柱分离得到了3种组分。采用元素分析、红外光谱、核磁共振、质谱等仪器对分离出来的物质进行了表征,最后成功确定了其中组分A和组分D的结构,即N, N′-二羟甲基硝胺和1, 9-二硝酰氧基-2, 4, 6, 8-四硝基-2, 4, 6, 8-四氮杂壬烷。
|
图 1 样品1的TLC图谱 Fig.1 TLC of sample 1 |
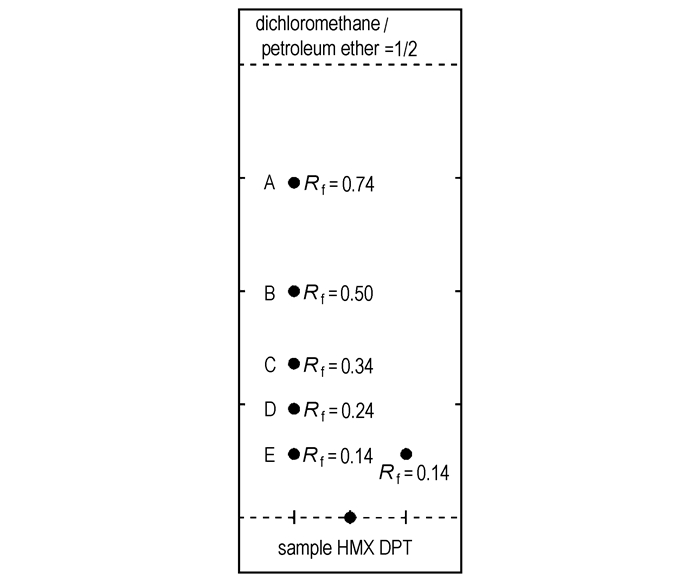
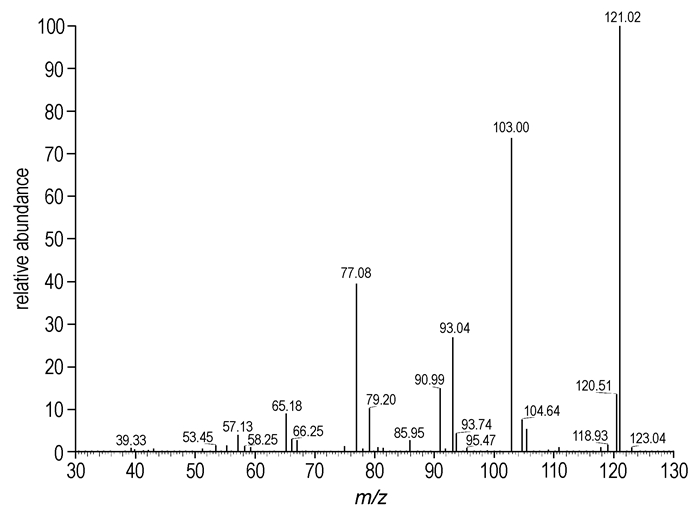
柱分离所得的组分A为浅黄色油状液体,由于其不稳定,容易分解,1H NMR图谱杂乱。从其MS图谱(图 2)可以清晰看到其碎片离子峰,其MS碎片离子峰按图 3的分解路径进行分解。FTIR(KBr, cm-1):3368, 2978, 1662, 1540, 1282, 1035, 934。元素分析(%),C2H6N2O14,计算值(实测值):C 19.68(19.87),H 4.95(4.73),N 22.95(23.03)。可以确定组分A是N, N′-二羟甲基硝胺。
|
图 2 N, N′-二羟甲基硝胺的MS谱图 Fig.2 Spectrum MS of N, N′-bis(hydroxymethyl)nitramide |
|
图 3 N, N′-二羟甲基硝胺的MS分解图 Fig.3 MS decomposition of N, N′-bis(hydroxymethyl)nitramide |
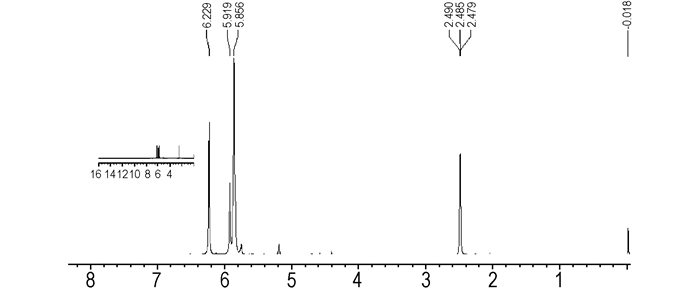
分离所得组分D的1H NMR化学位移(见图 4)与文献[10]报道的1, 9-二硝酰氧基-2, 4, 6, 8-四硝基-2, 4, 6, 8-四氮杂壬烷的HNMR化学位移相同:δ=6.29,δ=5.9,δ=5.9;组分D熔点:201~202 ℃(文献[8]报道熔点202~203 ℃); FTIR(KBr, cm-1):3041, 1679, 1552, 1253, 935, 834。元素分析(%),C5H10N10O14,计算值(实测值):C 13.83(13.80), H 2.30(2.43), N 32.26(32.23)。可以确定组分D为1, 9-二硝酰氧基-2, 4, 6, 8-四硝基-2, 4, 6, 8-四氮杂壬烷。
|
图 4 组分D的1H NMR谱图 Fig.4 1H NMR spectrum of component D |
乌洛托品硝解,反应体系具有高酸度和高活性时,容易形成六元环化合物; 反之,体系的酸度和活性较低时,容易形成八元环化合物。同理,当按照2.2.2中方法硝解DPT,N2O5浓度较高时,DPT反应断键在a处(Scheme 1)向六元环方向进行生成化合物Ⅰ,硝酸铵的去羟基和抑制酯化的作用较弱,大部分化合物Ⅰ被酯化形成化合物Ⅲ开环生成1, 9-二硝酰氧基-2, 4, 6, 8-四硝基-2, 4, 6, 8-四氮杂壬烷(化合物Ⅵ),同时,有少量Ⅰ被硝化生成RDX和N, N′-二羟甲基硝胺(化合物Ⅱ);当N2O5浓度较低时,DPT硝解反应断键在b处向八元环方向进行生成化合物Ⅳ,由于硝酸铵的去羟甲基和抑制酯化的作用较强,化合物Ⅳ主要被硝化生成HMX,同时少量化合物Ⅳ被酯化形成化合物Ⅴ开环生成直链产物Ⅵ。

|
Scheme1 Main nitrolysis mechanism of DPT |
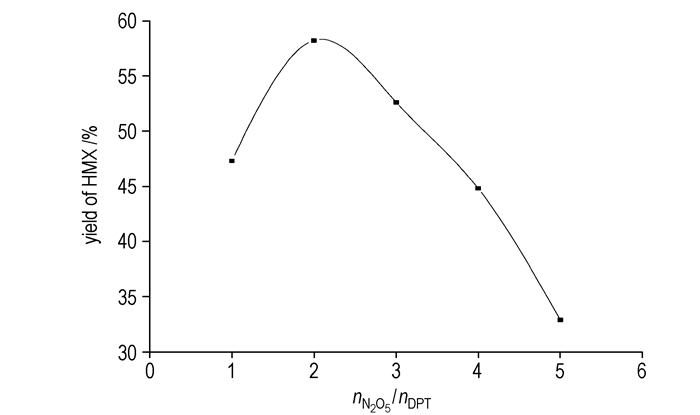
而N2O5/CH2Cl2体系中硝解DPT时,硝酸铵在该体系中不溶解,没有硝酸铵的抑制酯化的作用,没有HMX生成,产物通过柱分离得到了酯化产物Ⅵ。而当按2.2.2中的条件不添加硝酸铵用N2O5硝解DPT时,通过柱分离得到了直链产物Ⅵ,没有HMX生成,可能原因是没有了硝酸铵的去羟甲基和抑制酯化的作用,反应按酯化开环方式进行。图 5是硝酸铵存在下,N2O5/HNO3体系中硝解DPT时,随着N2O5浓度的变化HMX收率变化情况,但HMX的收率始终偏低,说明该反应体系除了我们分析的反应历程外还有其它的反应,反应远比我们想象的复杂,需对其反应中的副产物进一步分离,进行深入的研究。
|
图 5 N2O5用量对HMX产率的影响 Fig.5 Effect of N2O5 dosage on the yield of HMX |
N2O5硝解DPT时,当体系中溶解有硝酸铵,N2O5浓度低时主要起硝化作用反应生成HMX,N2O5浓度高时主要起酯化作用反应生成直链产物1, 9-二硝酰氧基-2, 4, 6, 8-四硝基-2, 4, 6, 8-四氮杂壬烷;当体系中没有硝酸铵(或不溶解)时,N2O5主要起酯化作用生成直链产物。制备HMX时硝酸铵应溶解在反应体系中,反应温度也不宜太低,应注意调整N2O5的浓度,尽量降低反应剂的酯化能力。
| [1] |
任特生.
硝酸酯炸药化学与工艺学[M]. 北京: 兵器工业出版社, 1994: 182-185.
|
| [2] |
华东工程学院302教研室合成组. 奥克托今综合工艺研究技术讨论会报告[J].
火炸药学报, 1979, 2: 12-15. Nanjing University of Science & Technology, Group 302. Octogen technical symposium on integrated technology report[J]. Chinese Journal of Explosives & Propellants, 1979, 2: 12-15. |
| [3] |
华东工程学院302教研室合成组. 非醋酐法合成HMX-DPT硝解部分的初步研究[J].
火炸药学报, 1979, 2: 57-64. Nanjing University of Science & Technology, Group 302. Synthesis of non-acetic anhydride nitrolysis part of HMX-DPT preliminary research[J]. Chinese Journal of Explosives & Propellants, 1979, 2: 57-64. |
| [4] |
陈里, 陈浙闽, 陈新虎. 在硝酸-硝酸盐体系中DPT硝解反应的探索[J].
火炸药学报, 1986(3): 1-5. CHEN Li, CHEN Zhe-min, CHEN Xin-hu. The explore of nitrolysis of DPT by nitrate and nitric acid system[J]. Chinese Journal of Explosives & Propellants, 1986(3): 1-5. |
| [5] |
奚美虹. 多磷酸法由DPT制备HMX研究[J].
含能材料, 1996, 4(2): 57-61. XI Mei-hong. Preparation HMX from DPT by multi-phosphoric acid[J]. Chinese Journal of Energetic Materials(Hanneng Cailiao), 1996, 4(2): 57-61. |
| [6] |
李全良, 陈军, 王建龙. DPT制备HMX工艺研究[J].
含能材料, 2007, 15(5): 509-510. LI Quan-liang, CHEN Jun, WANG Jian-long. Synthesis craft of HMX from 1, 5-methylene-3, 7-dintrio-1, 3, 5, 7-tetraazacyclooctane[J]. Chinese Journal of Energetic Materials(Hanneng Cailiao), 2007, 15(5): 509-510. |
| [7] |
ZHI Hui-zhen, LUO Jun, FENG Guang-an, et al. An efficient method to synthesize HMX by nitrolysis of DPT with N2O5 and a novel ionic liquid[J].
Chin Chem Lett, 2009, 20(4): 379-382. DOI:10.1016/j.cclet.2008.12.040 |
| [8] |
McKay A F, Richmond H H, Wright G F. Nitrolysis of 1, 5-endomethylene-3, 7-dinitro-1, 3, 5, 7-tetrazacyclooctane(DPT)[J].
Canadian Joural of Research, 1949, 27B: 462-468. DOI:10.1139/cjr49b-048 |
| [9] |
何志勇, 罗军, 吕春旭, 等. N2O5硝解DPT制备HMX[J].
火炸药学报, 2010, 33(2): 1-4. HE Zhi-yong, LUO Jun, Lü Chun-xu, et al. Synthesis of HMX from DPT by green nitrolysis with dinitrogen pentoxide[J]. Chinese Journal of Explosives & Propellants, 2010, 33(2): 1-4. |
| [10] |
Irvine J S, Robert K M, Frank H J, et al. Proton magnetic resonance data for some intermediates and products of nitrolysis of hexamethylenetetramine[J].
Journal of Chemical and Engineering Data, 1973, 18(3): 335-337. DOI:10.1021/je60058a020 |
| [11] |
Castorina T C, Holohan F S, Graybush R J. C-14 tracer studies of the nitrolysis of hexamethylenetetramine[J].
J Am Chem Soc, 1960, 82: 1617-1623. DOI:10.1021/ja01492a026 |